
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
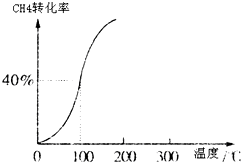 Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
Ⅰ、合成氨对农业生产及国防建设均具有重要意义.| 1 | 2 |
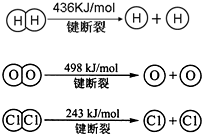
查看答案和解析>>
科目:高中化学 来源:2011-2012学年天津市高三寒假验收考试化学试卷 题型:填空题
(8分)(1)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。

(2)己知下列热化学方程式:

由此可知反应: 的焓变为
。
的焓变为
。
(3)在一固定体积的密闭容器中,进行如下化学反应:
 其化学平衡常数K与t的关系如下表:
其化学平衡常数K与t的关系如下表:

请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填写字母序号)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(正)(N2)=v(逆)(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
F.混合气体中各成分的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)(1)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)己知下列热化学方程式:
由此可知反应:的焓变为 。
(3)在一固定体积的密闭容器中,进行如下化学反应:
其化学平衡常数K与t的关系如下表:
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填写字母序号)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(正)(N2)=v(逆)(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
F.混合气体中各成分的浓度不再改变
查看答案和解析>>
科目:高中化学 来源:2012届天津市耀华中学高三寒假验收考试化学试卷 题型:填空题
(8分)(1)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)己知下列热化学方程式:
由此可知反应: 的焓变为 。
的焓变为 。
(3)在一固定体积的密闭容器中,进行如下化学反应: 其化学平衡常数K与t的关系如下表:
其化学平衡常数K与t的关系如下表:
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填写字母序号)
| A.容器内N2、H2、NH3的浓度之比为1:3:2 |
| B.2v(正)(N2)=v(逆)(H2) |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com