
【题目】下列各图表示的装置属于原电池的是( )
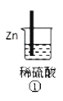
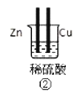
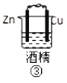
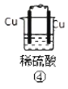
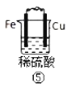
A.①②B.③④C.⑤D.③⑤
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。

已知:铅蓄电池在放电时发生下列电极反应:
负极:Pb+SO42--2e-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式__。
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为__极。
(3)用铅蓄电池电解200ml浓度为0.5mol/LCuSO4 溶液一段时间后
①若两极收集到的气体体积相等,则转移电子_____mol。
②阳极收集到的气体体积(标准状况下)为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种化工原料,可以制备一系列物质(见下图)。

下列说法正确的是
A. 元素C、D形成的简单离子半径,前者大于后者
B. F的热稳定性比H2S弱
C. 化合物A、F中化学键的类型相同
D. 元素C、D的最高价氧化物的水化物均可以和H发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
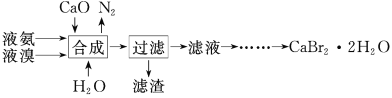
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作(装置如图):
![]()
使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,_______________。
(2)“合成”主要反应的化学方程式为__________________。“合成”温度控制在70℃以下,其原因是_________。投料时控制n(Br2)∶n(NH3)=1∶0.8,其目的是_________________。
(3)“滤渣”的主要成分为____________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,___________________。[实验中须使用的试剂:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器:砂芯漏斗,真空干燥箱]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上在一定条件下将丙烷脱氢制丙烯.
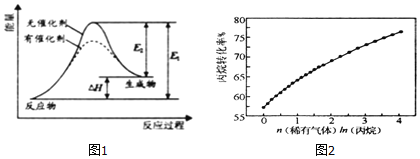
![]() 反应过程中能量变化如图1所示,下列有关叙述正确的是______.
反应过程中能量变化如图1所示,下列有关叙述正确的是______.
![]() 此反应为吸热反应
此反应为吸热反应
![]() 催化剂能改变反应的焓变和活化能
催化剂能改变反应的焓变和活化能
![]() 表示正反应的活化能,
表示正反应的活化能,![]() 表示逆反应的活化能
表示逆反应的活化能
![]() 有催化剂能加快反应速率,提高丙烷的转化率
有催化剂能加快反应速率,提高丙烷的转化率
![]() 上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为______
上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为______![]() 若升温,该反应的平衡常数______
若升温,该反应的平衡常数______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 若向上述反应达到平衡的容器内再通入少量丙烷,则
若向上述反应达到平衡的容器内再通入少量丙烷,则![]() ______
______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() .
.
![]() 在
在![]() 、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是______.
、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是______.
![]() 上述反应生成物丙烯经多步氧化生成丙酸,已知常温下
上述反应生成物丙烯经多步氧化生成丙酸,已知常温下![]() .
.
![]() 用离子方程式表示
用离子方程式表示![]() 溶液显碱性的原因______.
溶液显碱性的原因______.
![]() 常温下,若丙酸与氨水混合后溶液呈中性,则溶液中
常温下,若丙酸与氨水混合后溶液呈中性,则溶液中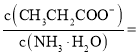 ______.
______.
![]() 已知:
已知:
化学键 |
|
|
|
|
键能 | 436 | 413 | 348 | 612 |
则丙烷脱氢反应的热化学方程式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1,则a>b
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH= -57.3 kJ·mol-1,则含1mol NaOH的稀溶液与足量稀醋酸完全中和,放出的热量等于57.3kJ
C.已知P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定
D.已知H2(g)+I2(g)![]() 2HI(g) ΔH= -a kJ·mol-1向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ
2HI(g) ΔH= -a kJ·mol-1向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中为实验室制取氯气及性质验证的装置图:
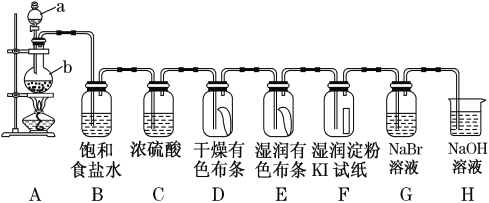
参考装置图回答下列问题:
(1)请指出仪器a的名称____________________,写出装置A中反应的化学方程式____________
(2)在装置D中可观察到的现象是________,装置E中可观察到的现象是__________。
(3)装置B的作用为_____,装置C的作用为____________,装置H的作用为_________,写出装置H中的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)写出⑧的氢化物和②的氢化物反应的化学方程式________。
(2)在元素①~⑧中,非金属性最强的元素是________(填元素名称)。
(3)写出元素②的最高价氧化物对应水化物的电离方程式________。
(4)写出⑤⑧最高价氧化物的水化物之间的离子反应________________。
(5)由②和⑧组成的化合物中各原子均满足稳定结构,写出该化合物的结构式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应2XY(g)![]() X2(g)+Y2(g) 达到平衡的标志是
X2(g)+Y2(g) 达到平衡的标志是
A. 单位时间内,生成nmolX2的同时,生成nmolXY
B. 单位时间内, 生成nmolX2的同时,生成nmolY2
C. 单位时间内,生成2nmolXY的同时,消耗nmolY2
D. 单位时间内,生成nmolX2的同时,消耗nmolY2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com