
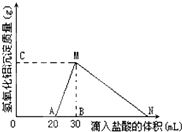
 ��10mL����AlO2-���ӵ���Һ����μ���1mol/L�����ᣬ����Al��OH��3������������������������ϵ��ͼ��ʾ���ʣ�
��10mL����AlO2-���ӵ���Һ����μ���1mol/L�����ᣬ����Al��OH��3������������������������ϵ��ͼ��ʾ���ʣ����� ��1����ͼ��֪���μ����Ὺʼ����������������Һ�л�����OH-����ʼ�����20mL���������к�OH-������H++OH-=H2O������Һ��n��OH-������20mL������n��HCl����
��2����ͼ��֪��MN�����������������ᷴӦ�����Ȼ�����ˮ��
��3������n=$\frac{m}{M}$������������������ʵ��������ݷ���ʽ������Һ��n��AlO2-�����ٸ���c=$\frac{n}{V}$����Ũ�ȣ�
��4����ͼ��֪�������ᵽ��N������������ǡ����ȫ�ܽ⣬��ʱ��Һ��������ΪCl-�����ݵ���غ��֪n��Cl-��=n��AlO2-��+n��OH-�����ݴ˼������������ܽ���Ҫ��������ʵ������������������
��� �⣺��1����ͼ��֪���μ����Ὺʼ����������������Һ�л�����OH-����ʼ�����20mL���������к�OH-������H++OH-=H2O������Һ��n��OH-��=n��H+��=0.02L��1mol/L=0.02mol��
�ʴ�Ϊ��0.02��OH-��
��2����ͼ��֪��MN�����������������ᷴӦ�����Ȼ�����ˮ����Ӧ���ӷ���ʽΪAl��OH��3+3H+=Al3++3H2O��
�ʴ�Ϊ��Al��OH��3+3H+=Al3++3H2O��
��3��C����M�����������Ϊ0.78����C�����������������������ʵ���Ϊ��$\frac{0.78g}{78g/mol}$=0.01mol��
���ݷ�ӦAlO2-+H++H2O�TAl��OH��3����֪��Һ��n��AlO2-��=n��H+��=0.01L��1mol/L=0.01mol��
��c��AlO2-��=$\frac{0.01mol}{0.01L}$=1mol/L��
�ʴ�Ϊ��1mol��
��4����ͼ��֪�������ᵽ��N������������ǡ����ȫ�ܽ⣬��ʱ��Һ��������ΪCl-�����ݵ���غ��֪n��Cl-��=n��AlO2-��+n��OH-��=0.01mol+0.02mol=0.03mol���ʴ˽����ĵ���������Ϊ$\frac{0.03mol}{1mol/L}$=0.03L=30mL����N������HCl��Һ�����Ϊ30mL+30mL=60mL��
�ʴ�Ϊ��60��
���� ���⿼�������仯��������ʡ��й�ͼ��Ļ�ѧ����ȣ���Ŀ�Ѷ��еȣ���ȷ���η����ķ�Ӧ�ǽ���Ĺؼ���������ؿ���ѧ���ķ�����������������ѧ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������ɳ���ʢ�Ÿ����� | |
| B�� | �����������ϴ���� | |
| C�� | Ũ��ˮ�ɼ��������ܵ�й© | |
| D�� | ˮ�������Ʊ��轺��ľ�ķ������ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
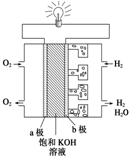 I����Դ�������������ᷢչ�Ļ��������������������Դ��̫���ܣ�����Ȼ������һ��Դ��ɹ�����ֲ��Ĺ�����ã����������ǿ����������ɫ��Դ����֪��������ֵ��143kJ•g-1����ֵָ������һ�������µ�λ������������ȫȼ�����ų�������������ת��ΪҺ̬ˮ������д������ȼ�յ��Ȼ�ѧ����ʽH2��g��+$\frac{1}{2}$O2��g��=H2O��1������H=-286kJ•mol-1��2H2��g��+O2��g��=2H2O��l����H=-572KJ•mol-1��
I����Դ�������������ᷢչ�Ļ��������������������Դ��̫���ܣ�����Ȼ������һ��Դ��ɹ�����ֲ��Ĺ�����ã����������ǿ����������ɫ��Դ����֪��������ֵ��143kJ•g-1����ֵָ������һ�������µ�λ������������ȫȼ�����ų�������������ת��ΪҺ̬ˮ������д������ȼ�յ��Ȼ�ѧ����ʽH2��g��+$\frac{1}{2}$O2��g��=H2O��1������H=-286kJ•mol-1��2H2��g��+O2��g��=2H2O��l����H=-572KJ•mol-1���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȩ���Ľṹ��ʽ-COH | B�� | ������ӵı���ģ��Ϊ��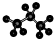 | ||
| C�� | ���Ȼ�̼���ӵĵ���ʽΪ 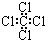 | D�� | 2-�һ�-1��3-����ϩ�ļ���ʽ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
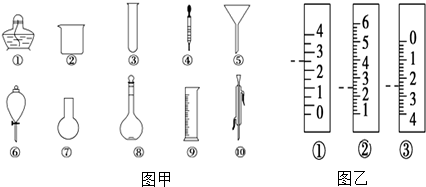
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH4 | B�� | CO | C�� | CO2 | D�� | SO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
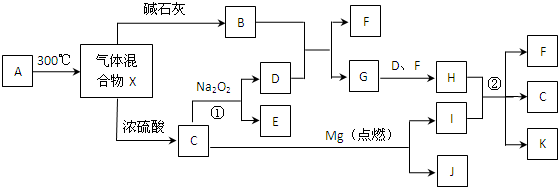
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ͬ��Ŀ��ԭ�� | B�� | ��ռ22.4 L | ||
| C�� | ������ͬ��Ŀ�ķ��� | D�� | ������ͬĦ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����A��B��C���ֶ�����Ԫ�أ�ԭ���������ε�����A��C��������֮��Ϊ27������������֮��Ϊ5��0.9g����B���������ᷴӦ���ռ�������1.12L����״��������ش��������⣺
����A��B��C���ֶ�����Ԫ�أ�ԭ���������ε�����A��C��������֮��Ϊ27������������֮��Ϊ5��0.9g����B���������ᷴӦ���ռ�������1.12L����״��������ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com