
| A. | H2O和D2O | B. | O2和O3 | ||
| C. | CH3CH2OH和CH3-O-CH3 | D. | 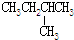 和 和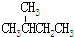 |
分析 分子式相同结构不同的化合物互称同分异构体;
同一元素形成的不同单质称同素异形体,同素异形体必须是单质;
元素组成相同,结构相同的物质为同一物质.
解答 解:A、H2O、D2O都是由氢元素、氧元素组成的,结构相同,为同一物质,故A错误;
B、O2和O3都是由氧元素组成的,属于同素异形体,故B错误;
C、CH3-CH2-OH和CH3-O-CH3 分子式相同,结构不同,CH3-CH2-OH属于醇,CH3-O-CH3 属于醚,二者互为同分异构体,故C正确;
D、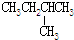 和
和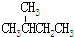 分子式相同,结构相同,为同一物质,故D错误;
分子式相同,结构相同,为同一物质,故D错误;
故选C.
点评 本题考查化学概念的分析比较,难度不大,注意:H2O、D2O为同一物质,同分异构体也存在于无机物中.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SiO3溶液与盐酸 | B. | CO2与足量石灰水 | ||
| C. | NaOH溶液与NaAlO2溶液 | D. | NaOH溶液与NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
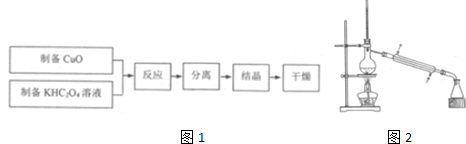
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  目的:验证乙炔的还原性 | |
| B. |  目的:收集氨气 | |
| C. |  操作:片刻后在Fe电极附近滴入 K3[Fe(CN)6]溶液,目的:验证Fe电极被保护 | |
| D. |  操作:①加入3滴同浓度的AgNO3溶液、②再加入3滴同浓度的Na2S溶液,目的:验证AgCl的溶解度大于Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
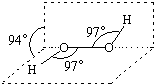 过氧化氢被称为绿色氧化剂,它的分子结构如图所示.已知该分子H-O-O键角都是97°.下列有关H2O2的说法正确的是( )
过氧化氢被称为绿色氧化剂,它的分子结构如图所示.已知该分子H-O-O键角都是97°.下列有关H2O2的说法正确的是( )| A. | 过氧化氢分子中存在离子键、共价键 | |
| B. | 在1.00mol H2O2中,核外电子总数为10×6.02×1023个 | |
| C. | 过氧化氢既有氧化性又有还原性 | |
| D. | 3.4g过氧化氢中含有6.02×1022个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
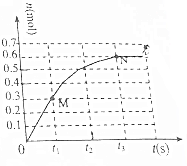 T℃时,向2L密闭恒容容器中充入1mol N2O4(无色气体)发生反应N2O4(g)?2NO2(g).其中NO2的物质的量随时间的变化如图所示.
T℃时,向2L密闭恒容容器中充入1mol N2O4(无色气体)发生反应N2O4(g)?2NO2(g).其中NO2的物质的量随时间的变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com