
【题目】现用98%的浓硫酸(密度:1.84g/ml)配制成浓度为0.5mol/L的稀硫酸500mL。
(1)选用的主要玻璃仪器有:烧杯、玻璃棒、_______、_______。
(2)所需浓硫酸体积为______mL(保留一位小数)。量取浓硫酸时发现量筒不干净,用水洗净后直接量取将使实验结果__________(填“偏高”、“偏低”、“无影响”)。
(3)在转入容量瓶前烧杯中液体应_______,否则会使浓度______(填“偏高”、“偏低”、“无影响”)。
【答案】500mL容量瓶 胶头滴管 13.6mL 偏低 冷却至室温 偏高
【解析】
浓H2SO4的物质的量浓度c(H2SO4)=![]() ,根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;根据浓硫酸的体积选择量筒的规格;根据c=
,根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;根据浓硫酸的体积选择量筒的规格;根据c=![]() ,分析操作对溶质的物质的量或对溶液的体积的影响判断误差;
,分析操作对溶质的物质的量或对溶液的体积的影响判断误差;
浓硫酸注入水中,放出大量热,用玻璃棒搅拌均匀,使热量迅速分散,防止液体飞溅;
根据热溶液冷却后体积变小,分析对配制溶液浓度的影响。
(1)配制一定物质的量浓度溶液时,需要相应规格的容量瓶,定容时需要胶头滴管,故主要玻璃仪器有:500mL容量瓶、胶头滴管,本题答案为500mL容量瓶、胶头滴管;
(2)浓H2SO4的物质的量浓度c=1000ρw/M=18.4mol/L,根据稀释定律,计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.5mol/L,解得:x≈13.6,所以应量取的浓硫酸体积是13.6mL;量取时发现量筒不干净,用水洗净后直接量取,溶质的物质的量偏低,配制溶液的浓度偏低;本题答案为:13.6mL、偏低;
(3)浓硫酸稀释过程中放出大量的热,在转入容量瓶前烧杯中液体应该冷却至室温,否则导致配制的溶液体积偏小,根据c=n/V,可得,配制的溶液浓度偏高,本题答案为:冷却至室温、偏高。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述,正确的是
A. 新制氯水中只含Cl2和H2O分子
B. 新制氯水可使蓝色石蕊试纸先变红后褪色
C. 光照氯水有气泡逸出,该气体是Cl2
D. 氯水放置数天后酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图中四个图像的说法正确的是
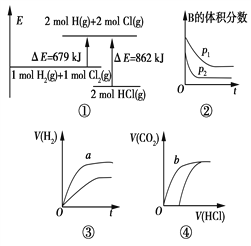
注:图中,E表示能量,p表示压强,t表示时间,y表示体积。
A. ①表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,则该反应的反应热ΔH=183 kJ/mol
B. ②表示其他条件不变时,反应4A(g)+3B(g) ![]() 2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是非气体。
2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是非气体。
C. ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示HCl溶液。
D. ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘对动植物的生命是极其重要的,海水里的碘化物和碘酸盐参与大多数海生物的新陈代谢。在高级哺乳动物中,碘以碘化氨基酸的形式集中在甲状腺内,缺乏碘会引起甲状腺肿大。
I.现要从工业含碘废液中回收碘单质(废液中含有H2O、油脂、I2、I)。设计如图一所示的实验过程:
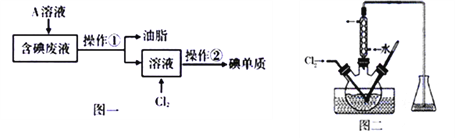
(1)为了将含碘废液中的I2完全转化为I—而进入水层,向含碘废液中加入了稍过量的A溶液,则A应该具有___________性。
(2)将在三颈烧瓶中反应完全后的溶液经过操作②获得碘单质,操作②包含多步操作,操作名称分别为萃取、_____、_____,在操作②中必须用到下列所示的部分仪器或装置,这些仪器和装置是________________(填标号)。

(3)将操作①所得溶液放入图二所示的三颈烧瓶中,并用盐酸调至pH约为2,再缓慢通入适量Cl2,使其在30~40℃反应。写出其中发生反应的离子方程式________________;Cl2不能过量,因为过量的Cl2将I2氧化为IO3-,写出该反应的离子方程式__________。
II.油脂的不饱和度可通过油脂与碘的加成反应测定,通常称为油脂的碘值。碘值越大,油脂的不饱和程度越高。碘值是指100g油脂所能吸收的I2的克数。称取xg某油脂,加入含ymol I2的韦氏溶液(韦氏溶液是碘值测定时使用的特殊试剂,含有CH3COOH),充分振荡;过量的I2用cmol/L Na2S2O3标准溶液滴定(淀粉作指示剂),消耗Na2S2O3溶液V mL(滴定反应为:2Na2S2O3+I2=Na2S4O6+2NaI)。回答下列问题:
(1)下列有关滴定的说法不正确的是________(填标号)。
A.标准Na2S2O3溶液应盛装在碱式滴定管中
B.滴定时眼睛只要注视滴定管中溶液体积的变化
C. 滴定终点时,俯视读数,导致测定结果偏低
D.滴定到溶液由无色变蓝色时应该立即停止滴定
(2)用该测定方法测定的碘值需要用相关的实验校正,因为所测得的碘值总比实际碘值低,原因是_______________________________________________。
(3)该油脂的碘值为_____g(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、Q的原子序数依次增大,c、d、e、f、h是由这些元素组成的二元化合物,自然界中硬度最大的单质和a都由X组成,b由W、Y、Q三种元素组成0.05mol/Lb溶液的pH为1,d能使品红溶液褪色,e是液体,f的焰色反应为黄色,上述物质的转化关系如图所示(个别产物略去)。下列说法错误的是( )
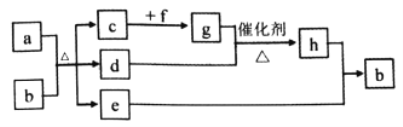
A. 二元化合物沸点:e>d>c B. 氢化物的稳定性:Q>Y>X
C. 元素的非金属性:Y>X>W D. 原子半径的大小:Z>Q>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种重要的过渡元素,钼钢是制火箭发动机的重要材料,钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼矿(主要成分MoS2)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
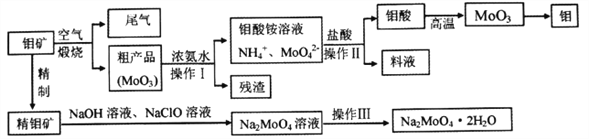
(1)Na2MoO4·2H2O中元素的价态为_________,工业煅烧钼矿的尾气用过量的氨水处理,反应的离子方程式为________________________________________________。
(2)由图中信息可以判断MoO3是____________氧化物。(填“酸性”、“碱性”或“两性”)
(3)采用 NaClO氧化精钼矿的方法将矿石中的钼浸出,该过程放热,其化学反应为:NaClO+MoS2+NaOH→Na2MoO4+Na2SO4+NaCl+H2O,该反应配平后, NaClO与MoS2的系数比为____________。随着温度升高,钼的浸出率的变化如图,高于50℃后浸出率降低的可能原因是____________________________________(写两点)。
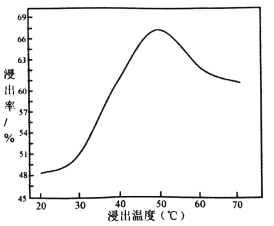
(4)操作Ⅲ主要包括____________,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是____________________________________。
(5)锂和MoS2可充电电池的工作原理为xLi+nMoS2![]() Li(MoS2)n,则电池充电时阳极上的电极反应式为______________________。
Li(MoS2)n,则电池充电时阳极上的电极反应式为______________________。
(6)某工厂用1.00×103吨粗钼矿(含MoS216.00%)制备钼单质,已知冶炼过程中,钼的损耗率为10.00%,则最终得到钼单质质量为___________吨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解法制备硼酸[H3BO3或B(OH) 3]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是( )

A. 阴极与阳极产生的气体体积比为1:2 B. b极的电极反应式为2H2O-2eˉ=O2↑+4H+
C. 产品室中发生的反应是B(OH)3+OHˉ=B(OH)4ˉ D. 每增加1 mol H3BO3产品,NaOH溶液增重22g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)是高性能磁性材料,金属钨是重要的战略物资。由黑钨矿(主要成分为FeWO4、MnWO4,少量SiO2)制取碳酸锰和金属钨的流程如下:

已知:①钨酸(H2WO4)酸性很弱,难溶于水,其钠盐易溶于水。②SiO32-和WO42-完全沉淀的pH分别为8、5。③草酸(H2C2O4)具有酸性和还原性,能分解。
回答下列问题:
(1)将矿石粉碎的目的是_____________________。
(2)固体(X)的化学式是____________________________。
(3)写出高温焙烧过程中,MnWO4发生反应的化学方程式________________。
(4)MnO2与硫酸、草酸反应的离子方程式是__________________________。测得一定量MnO2完全溶解的时间与温度的关系如图所示,分析控温加热75℃时MnO2溶解所需时间最少的原因__________________。

(5)滤液Ⅱ调节pH应选择的试剂为_________________。
A.WO3 B.氨水 C.稀盐酸 D.NaHCO3
(6)用Na2CO3溶液沉淀Mn2+时,应控制MnSO4溶液的pH不超过8,防止生成Mn(OH)2,用Na2CO3溶液沉锰采取的操作方法是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com