
【题目】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857 ℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
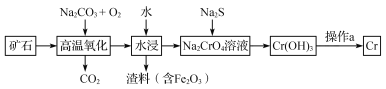
①Fe(CrO2)2中各元素化合价均为整数,则铬为_______价。
②高温氧化时反应的化学方程式为___________________________________。
③操作a由两种均发生了化学反应的过程构成的,其内容分别是_______________、铝热反应。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式____________________________。
(3)铬元素能形成含氧酸及含氧酸盐,若测得初始浓度为1 mol/L的铬酸 (H2CrO4) 溶液中各种含铬元素的微粒浓度分别为:c(![]() )=0.0005 mol·L1、c(
)=0.0005 mol·L1、c(![]() )=0.1035 mol·L1、c(
)=0.1035 mol·L1、c(![]() )=a mol·L1、则a=______,KHCrO4溶液中c(OH)___c(H+)(填“>”、“<”或“=”)。
)=a mol·L1、则a=______,KHCrO4溶液中c(OH)___c(H+)(填“>”、“<”或“=”)。
(4)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。
①处理含有![]() 的污水方法通常为:用铁作电极电解污水,
的污水方法通常为:用铁作电极电解污水,![]() 被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为_________________________,若要处理含10 mol
被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为_________________________,若要处理含10 mol ![]() 的污水,则至少需要消耗的铁为_______g。
的污水,则至少需要消耗的铁为_______g。
②转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含![]() 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出![]() 在酸性条件下被Fe2+还原为Cr3+ 的离子方程式:____________________________________,若处理含1 mol
在酸性条件下被Fe2+还原为Cr3+ 的离子方程式:____________________________________,若处理含1 mol![]() (不考虑其它含铬微粒) 的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为__________。
(不考虑其它含铬微粒) 的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为__________。
【答案】(1) ①+3 (1分) ②4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2(2分) ③灼烧使 Cr(OH)3分解 (或其它合理说法,1分)
2Fe2O3+8Na2CrO4+8CO2(2分) ③灼烧使 Cr(OH)3分解 (或其它合理说法,1分)
(2)NaCrO2、Cr2(SO4)3(2分)
(3)0.448(1分) <(1分)
(4)①2H2O+2e![]() 2OH+H2 ↑(或者2H++2e
2OH+H2 ↑(或者2H++2e![]() H2↑)(1分) 3360(2分)
H2↑)(1分) 3360(2分)
②3Fe2++![]() +8H+
+8H+![]() 3Fe3++Cr3++4H2O(2分) Cr2Fe20O27(2分)
3Fe3++Cr3++4H2O(2分) Cr2Fe20O27(2分)
【解析】(1) ①Fe(CrO2)2中各元素化合价均为整数,若Fe的化合价为+3,则Cr的化合价为+![]() ,不为整数,若Fe的化合价为+2,则Cr的化合价为+3,为整数,符合题意。 ②由流程图知,高温氧化时的生成物有Fe2O3、Na2CrO4、CO2,由此可写出:Fe(CrO2)2+O2+Na2CO3→Fe2O3+Na2CrO4+CO2,配平即可。③铝热反应是单质铝与难熔金属氧化物之间的反应,故另一种变化是灼烧使Cr(OH)3分解成Cr2O3。
,不为整数,若Fe的化合价为+2,则Cr的化合价为+3,为整数,符合题意。 ②由流程图知,高温氧化时的生成物有Fe2O3、Na2CrO4、CO2,由此可写出:Fe(CrO2)2+O2+Na2CO3→Fe2O3+Na2CrO4+CO2,配平即可。③铝热反应是单质铝与难熔金属氧化物之间的反应,故另一种变化是灼烧使Cr(OH)3分解成Cr2O3。
(2)可根据Al(OH)3与NaOH、硫酸反应的情况进行类比。
(3)由于溶液中没有H2CrO4分子,故H2CrO4是强酸,根据铬元素守恒可求出a=0.448。KHCrO4溶液中,![]() 能电离但不能水解,故溶液显酸性,c(OH-)<c(H+)。
能电离但不能水解,故溶液显酸性,c(OH-)<c(H+)。
(4)① 阴极上是H+得到电子生成氢气,阳极上是单质铁失去电子转化为Fe2+,然后Fe2+将![]() 还原为Cr3+,本身则被氧化为Fe3+,依得失电子守恒原理知还原10 mol
还原为Cr3+,本身则被氧化为Fe3+,依得失电子守恒原理知还原10 mol ![]() ,需要消耗60 mol Fe2+,故阳极上溶解的铁为60 mol,质量为3360 g。②由题给条件知
,需要消耗60 mol Fe2+,故阳极上溶解的铁为60 mol,质量为3360 g。②由题给条件知![]() 被还原为Cr3+,Fe2+被氧化为Fe3+,反应的离子方程式为3Fe2++
被还原为Cr3+,Fe2+被氧化为Fe3+,反应的离子方程式为3Fe2++![]() +8H+
+8H+![]() 3Fe3++Cr3++4H2O。由铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2及加入的亚铁盐总量为10 mol知,磁性铁铬氧体中n(Fe2+)=6 mol、n(Fe3+)=4 mol,n(Cr3+)= 1 mol,依化合价规则,2z=1
3Fe3++Cr3++4H2O。由铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2及加入的亚铁盐总量为10 mol知,磁性铁铬氧体中n(Fe2+)=6 mol、n(Fe3+)=4 mol,n(Cr3+)= 1 mol,依化合价规则,2z=1![]() 3+6
3+6![]() 2+3
2+3![]() 4,z=13.5,故磁性铁铬氧体的化学式为Cr2Fe20O27。
4,z=13.5,故磁性铁铬氧体的化学式为Cr2Fe20O27。


科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是重要的化学试剂,可由如下反应制取: SO2(g)+Cl2(g)![]() SO2Cl2(g) △H
SO2Cl2(g) △H
针对该反应回答下列问题:
(1)已知:①SO2(g)+Cl2(g)+SCl2(g)![]() 2SOCl2(g) △H1=﹣aKJ·mol﹣1
2SOCl2(g) △H1=﹣aKJ·mol﹣1
②SO2Cl2+SCl2(g)=2SOCl2(g)△H2=﹣bKJ·mol﹣1
则△H= _______ kJ·mol﹣1(用含 a、b 的代数式表示,a>b>0)
(2)若在催化剂作用下,将nmol SO2与nmolCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P.起始时气体总体积为10L,t min时反应达到平衡状态,此时气体总体积为8L.
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示.则υ(SO2)=_______ mol/min。
②此温度下,该反应的K=________ L/mol。
③相同条件下,若将0.5nmolSO2与 0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是_______.
(3)该反应的产物 SO2Cl2遇水发生剧烈水解生成两种强酸,写出其化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)已知H3AsO3是两性偏酸性的化合物,H3AsO3中As的化合价为_____,它与足量硫酸反应时生成盐的化学式为_______________。Na2HAsO3溶液呈碱性,原因是_________________(用离子方程式表示),该溶液中c(H2AsO3-) _____c(AsO33-)(填”>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷、鉴定砒霜(As2O3)的原理如下图:

反应a产生的废气直接排放可能带来的环境问题是_______________,请写出反应b的化学方程式:_________________________。
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为_________。
③向c(As3+)=0.01mol/L的工业废水中加入FeS固体至砷完恰好完全除去(小于1×10-5mol/L),则此时c(Fe2+)=_____mol/L。(已知Ksp(As2S3)=1×10-22,Ksp(FeS)=6×10-18)
(3)某原电池装置如右图,电池总反应为AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。
AsO33-+I2+2OH-。

当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是短周期非金属元素,核电荷数依次增大。A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素。D、E是第四周期元素,其中E元素的核电荷数为29。D原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物易液化的原因是 ;
(3)已知A、C形成的化合物分子甲会造成温室效应,l mol甲中含有π键的数目为 ;
(4)基态D原子的外围电子排布式为 。DO2Cl2熔点:-96 .5℃,沸点: 117℃,则固态DO2Cl2属于 晶体。

(5)E的氢化物的晶胞结构如图所示,其化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele)。有一种有机物的键线式也酷似牛形(下图所示),故称为牛式二烯炔醇。下列有关说法正确的是( )

A.牛式二烯炔醇含有4种官能团
B.牛式二烯炔醇不能使酸性KMnO4溶液褪色
C.1 mol牛式二烯炔醇最多可跟4mol Br2发生加成反应
D.该有机物的化学式为C29H44O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是一种重要的液体化工原料,沸点38.4 ℃,难溶于水且为非电解质,可与碱溶液反应。实验室中可利用如下原理制取少量溴乙烷:
H2SO4(浓)+NaBr+C2H5OH→C2H5Br+NaHSO4。
某研究性学习小组的同学设计了如图所示的装置(支持及加热仪器已省略)来制备溴乙烷,并验证有副产物SO2、CO2、C2H4生成(SO2沸点10 ℃)。

(1)仪器B的名称是________,装置D用来检验并除去乙烯,则D中的试剂是________,F的用途是_____________________________________________________,证明一定有CO2生成的现象是__________________________________。
(2)C中所得到的溴乙烷中含有少量的乙醇、Br2、HBr。为得到纯净的溴乙烷,该同学取出C中的液体依次用水洗→___________洗→水洗,再用__________干燥,最后进行蒸馏。洗涤实验中,所用的玻璃仪器除烧杯外还一定需要的仪器名称是__________。
(3)假设上述实验都得到了预期的实验现象,写出乙醇与浓硫酸反应生成上述无机气体时的化学方程式:___________________________________。
(4)小组的同学对产品有存在溴单质的原因及验证方法进行了分析讨论。
①含有溴单质的依据是__________________________________。
②请设计一种实验方案,利用化学方法证明C中的液体中含有单质溴:_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是制备NH4NO3和Na2S2O4的一种工艺流程:(已知HNO2为弱酸)

(1)装置Ⅰ的作用为 ,写出该装置中反应的离子方程式 。
(2)若装置Ⅱ中产生的硝酸根和亚硝酸根的物质的量比为1∶1,写出反应的离子方程式_______;区别硝酸钠和亚硝酸钠晶体的方法是(写一种)______。
(3)装置Ⅳ中不通入氧气会产生的后果是________。
(4)若起始时通入等物质的量的NO和SO2,则通入n(NH3)∶ n(O2)=_________(假设过步骤中均完全转化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳整理是科学学习的重要方法之一。氧族元素的部分性质归纳整理如下:
|
|
|
|
|
单质熔点/℃ | -218,4 | 113 | ? | 450 |
单质沸点/℃ | -183 | 444.6 | 685 | 989 |
主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | ? |
原子半径/nm | 0.074 | 0.102 | ? | 0.136 |
单质与氢化合的难易程度 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接 |
请根据上表数据以及数据变化趋势,回答下列问题:
(1)硒的熔点范围可能是:________________;
(2)碲(Te)可能的化合价有:___________________;
(3)硒(Se)的原子半径可能在_______________________之间。
(4)从单质与氢化合的难易程度可以推测出,O、S、Se、Te的非金属性逐渐_________(增强、减弱)。
查看答案和解析>>
科目:高中化学 来源: 题型:
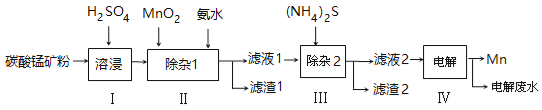
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。(至少答两条)
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为
。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+) :c(Ni2+)= 。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com