
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1) 催化反硝化法中,H2能将NO3—还原为N2,25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应离子方程式为 ,其平均反应速率v(NO3—)为 。
|
④在NaNO2 溶液中,质子守恒表达式为
___________________________________________。
(2)电化学降解NO3—的原理如右图所示。
| |
阴极反应式为:
。
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(重庆卷带解析) 题型:填空题
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应的离子方程式为 ,其平均反应速率υ(NO3-)为 mol·L-1min-1。
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如图所示。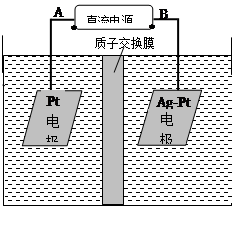
①电源正极为 (填A或B),阴极反应式为 。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为 g。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省新民市高三上学期期末考试化学试卷(解析版) 题型:选择题
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理图所示。下列说法不正确的是:
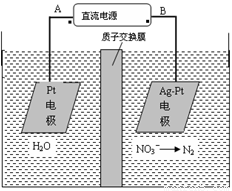
A.A为电源正极
B.阳极反应式为:2H2O-4e-=4H++O2↑
C.若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为10.4克
D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(重庆卷解析版) 题型:填空题
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应的离子方程式为 ,其平均反应速率υ(NO3-)为 mol·L-1min-1。
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如图所示。

①电源正极为 (填A或B),阴极反应式为 。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com