
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
A. △H4=2/3(△H1+△H2-3△H3)
B. △H4=2/3(3△H3-△H1-△H2)
C. △H4=3/2(△H1+△H2-3△H3)
D. △H4=3/2(△H1-△H2-3△H3)
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1000molL-1NaOH溶液分别滴定20.00mL浓度均为0.1000molL-1CH3COOH溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是( )
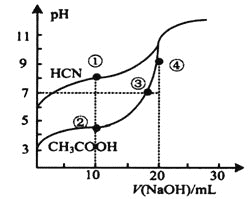
A.点①时:c(HCN)>c(Na+)>c(CN-)>c(OH-)
B.点②时:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-)
C.c(CH3COOH)+c(CH3COO-)+c(Na+)的值:③点等于④点
D.恰好完全中和时,将两种溶液混合后:c(HCN)+c(CH3COOH)>c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的质子数是Y的2倍,X、Y、W在周期表中的相对位置关系如下图。下列说法正确的是

A.五种元素中原子半径最大的是X,离子半径最大的是Q离子
B.五种元素中Q的最高价氧化物所对应的水化物的酸性最强
C.Y与Z形成的化合物一定是碱性氧化物
D.Z与Q形成的化合物水溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为前四周期元素,且原子序数依次增大。气体AB遇空气变红棕色,C原子内层电子数是最外层电子数的5倍,D在同周期元素中电负性最大,E的硫酸盐溶液呈蓝色。回答下列问题:
(1)A原子有________种能量不同的电子;D原子的M能层电子的运动状态有________种。
(2)元素A的第一电离能________(填“大于”“小于”或“等于”)元素B的第一电离能;AB2-的立体构型是________;气体AB中含有的σ键和π键个数之比为________。
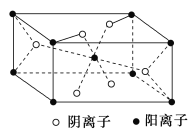
(3)元素C与D所形成的化合物的某种晶胞结构如图所示,则晶胞中阴离子与阳离子的个数比是________.
(4)E基态原子的核外电子排布式为________,将E单质的粉末加入A的简单气态氢化物的浓溶液中,并不断鼓入空气充分反应,得到深蓝色的溶液,该反应的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的的是______ 。
序号 | 实验内容 | 实验目的 |
A | 盛有 | 探究浓度对反应速率的影响 |
B | 用石墨电极电解 | 比较确定铜和镁的金属活动性强弱 |
C | 在容积可变的密闭容器中发生反应:2NO2(g) | 正反应速率加快,逆反应速率减慢 |
D | 向2支试管中各加入相同体积、相同浓度的 | 探究温度对反应速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硫酸铁净水原因(离子方程式):_____,SnCl2水解成碱式氯化亚锡(化学方程式)_____,要除去CuCl2溶液中FeCl3,可以向溶液中加入_______,将AlCl3溶液蒸干并灼烧所得固体的化学式为___。
(2)以石墨为电极,电解FeI2溶液,阳极电极反应式为________,利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
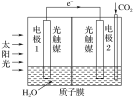
①电极2的电极反应式是_______;
②在标准状况下,当电极2室有11.2 L CO2反应。理论上电极1室液体质量___ (填“增加”或“减少”)___ g。
(3) 离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的_____极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为__________。
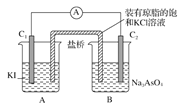
(4)已知AsO43—+2I-+2H+![]() AsO33—+I2+H2O是可逆反应,设计如图装置(C1、C2均为石墨电极)开始时:C2棒电极反应式______,当电流表___时,反应达到化学平衡状态。
AsO33—+I2+H2O是可逆反应,设计如图装置(C1、C2均为石墨电极)开始时:C2棒电极反应式______,当电流表___时,反应达到化学平衡状态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较下列几种溶液混合后各离子浓度的大小。
(1)CH3COOH和NaOH等浓度等体积混合,离子浓度大小顺序为__________________。
(2)NaOH和CH3COOH等浓度按1∶2体积比混合后pH<7,离子浓度大小关系_______。
(3)pH=2的CH3COOH与pH=12的NaOH等体积混合,离子浓度大小关系______。
(4)将标准状况下2.24LCO2缓慢通入1L0.15mol·L-1的NaOH溶液中,气体被充分吸收,离子浓度大小关系________。
(5)通过 本题的解答,总结若要比较溶液中离子浓度大小顺序,应先确定_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一直反应:2NO2(红棕色)![]() N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
n(NO2) | 0.40 | a | 0.26 | c | d | e |
n(N2O4) | 0.00 | 0.05 | b | 0.08 | 0.08 | 0.08 |
(1)a、b、c、d、e中属于平衡状态的是_____________,100s后降低反应混合物的温度,混合气体的颜色_________(填“变浅”、“变深”或“不变”)。
(2)20~40s内,v(NO2)=__________mol/(L·s),100℃时该反应的平衡常数K =_____________。
(3)将一定量的NO2充入密闭注射器中,图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是______________

A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若密闭注射器为绝热容器,则T(b)>T(c)
D.d点时v(正)>v(逆)
(4)能说明反应2NO2(红棕色)![]() N2O4(无色)达平衡的是_________
N2O4(无色)达平衡的是_________
A. 体系的颜色不变
B. 恒容条件下,气体的额密度不变
C. 2v正(NO2)=v逆(N2O4)/p>
D. 混合气体的平均摩尔质量不变
(5)100℃时,容器中物质的量的变化曲线如图,请画出80℃时物质的量的变化曲线并进行适当标注。______

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com