
| A. | ①②③ | B. | ④⑤⑥ | C. | ③④⑤ | D. | ②③⑤ |
分析 ①蔗糖中不含-CHO;
②皂化反应生成高级脂肪酸钠和甘油均溶于水;
③淀粉和纤维素均为多糖,相对分子质量均在10000以上;
④蛋白质遇硫酸钠溶液发生盐析;
⑤醋酸、KI与碘酸钾发生氧化还原反应生成碘;
⑥油中含碳碳双键,与溴水发生加成反应.
解答 解:①蔗糖中不含-CHO,不具有还原性,而麦芽糖是还原性糖,故错误;
②皂化反应生成高级脂肪酸钠和甘油均溶于水,则静置不分层,说明水解完全,故正确;
③淀粉和纤维素均为多糖,相对分子质量均在10000以上,都是天然高分子化合物,故正确;
④蛋白质遇硫酸钠溶液发生盐析,而蛋白质遇硫酸铜溶液会发生变性,故错误;
⑤醋酸、KI与碘酸钾发生氧化还原反应生成碘,淀粉变蓝,可检验,故正确;
⑥油中含碳碳双键,与溴水发生加成反应,而脂与溴水不反应,故错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、常见有机物的组成及结构等为解答的关键,侧重于学生的分析能力和应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
 如图把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池.某实验兴趣小组做完实验后,在读书卡上的记录如下所示,则卡片上的描述合理的是( )
如图把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池.某实验兴趣小组做完实验后,在读书卡上的记录如下所示,则卡片上的描述合理的是( )| A. | ①②③ | B. | ②④ | C. | ④⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将碳酸钾加入氯化钠溶液中 | B. | 在硫酸铜溶液中加入铁片 | ||
| C. | 在盐酸中加入氢氧化钠溶液 | D. | 让铁丝在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75%的酒精溶液 | B. | 硝酸钠(固态) | C. | Fe(OH)3胶体 | D. | 豆浆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:CO>N2 | B. | 水溶性:HCl>H2S>SO2 | ||
| C. | 还原性:HF>HCl>HBr>HI | D. | 沸点:HF>H2O>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
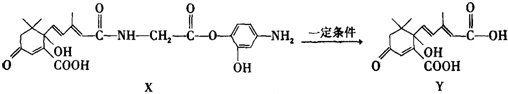
| A. | 1mol X与足量NaOH溶液反应,最多消耗4mol NaOH | |
| B. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| C. | X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐 | |
| D. | X结构中有2个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NaHSO4晶体中离子总数为2NA | |
| B. | 4.4g 14CO2含中子数为2.4NA | |
| C. | 0.3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3NA | |
| D. | 1 molFe在氧气中燃烧失去的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该井水中肯定有Fe3+ | |
| B. | 该井水中肯定有Fe2+ | |
| C. | 红褐色不溶物是Fe(OH)3 | |
| D. | 红褐色不溶物是由于氧化和水解产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com