
【题目】下列试剂不能用来鉴别乙醇和乙酸的是
A. 紫色石蕊试液B. 碳酸钠溶液C. 蒸馏水D. 酸性高锰酸钾溶液
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】在等体积的NaCl、MgCl2、A1C13三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为
A. 1:2:3 B. 3:2:1 C. 1:1:1 D. 6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( ) 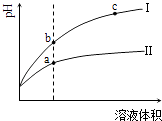
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的+1价化合物如Cu2O、CuCl都是重要的化工产品,研究它们的制备及其性质具有重大的现实意义.
(1)Cu2O是一种具有独特光、磁特性的红棕色p型半导体材料.
(i)工业上可以用新制Cu(OH)2悬浊液与液态肼(N2H4)反应制备Cu2O,同时放出N2 , 下列对应的化学反应方程式:
(ii)已知常温下,溶液中的Cu+易在酸性条件下发生反应:2Cu+=Cu2++Cu.写出稀硫酸与Cu2O反应的离子方程式
(2)氯化亚铜(CuCl)微溶欲水,不溶于酒精,在潮湿空气中易水解氧化.某课外小组以某工业废渣(主要成分为硅,铜,碳等)为原料制备CuCl的流程示意图如图: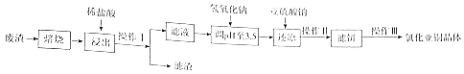
(i)“滤渣”的主要成分为(填化学式).
(ii)“还原”过程中SO32﹣将Cu2+还原为CuCl,请写出反应的例子方程式: , 亚硫酸钠需适当过量,目的有 .
(iii)操作Ⅰ和操作Ⅱ所用的玻璃仪器为 . 操作Ⅲ包括对滤饼的醇洗,干燥,使用无水乙醇代替水进行洗涤的优点是
(iv)CuCl是共价化合物,经测定其蒸气对H2的相对密度为99.5,测它的准确的分子式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若氖原子质量是ag,12C的原子质量是bg,NA是阿伏伽德罗常数的值,下列说法不正确的是( )
A.该氖原子的相对原子质量是12 ![]()
B.该氖原子的摩尔质量是aNAg
C.Wg该氖原子的物质的量是 ![]() mol
mol
D.Wg该氖原子所含质子数是10W/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】850℃时反应A(g)+B(g) ![]() C(g)+D(g)△H<0,该温度下平衡常数K=l.t℃时,在一定体积的容器中,通入一定量的A和B发生化学反应,各物质浓度随时间变化如下表:t℃时物质的浓度(molL﹣1)变化
C(g)+D(g)△H<0,该温度下平衡常数K=l.t℃时,在一定体积的容器中,通入一定量的A和B发生化学反应,各物质浓度随时间变化如下表:t℃时物质的浓度(molL﹣1)变化
时间/min | A | B | C | D |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | 0.100 | 0.200 | 0.100 | 0.100 |
4 | 0.100 | 0.200 | 0.100 | 0.100 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(1)计算t℃该化学反应的平衡常数:
(2)t℃850℃(填大于、小于或等于).判断依据是
(3)反应在4min~5min之间,平衡(填“向左”、“向右”或“不”)移动,可能的原因是
a.增加A的浓度 b.增加D的浓度 c.加压 d.使用催化剂
(4)某温度下反应C(g)+D(g)A(g)+B(g)的平衡浓度符合c(C)c(D)=2c(A)c(B),则此时的温度850℃(填大于、小于或等于).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应: 
①N2(g)+O2(g)2NO(g)△H1=a kJmol﹣1
②2NO(g)+O2(g)2NO2(g)△H2=b kJmol﹣1
③CO(g)+ ![]() O2(g)CO2(g)△H3=c kJmol﹣1
O2(g)CO2(g)△H3=c kJmol﹣1
④2CO(g)+2NO(g)N2(g)+2CO2(g)△H4
请回答下列问题:
(1)根据反应①②③,确定反应④中△H4=kJmol﹣1 .
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp=(用表达式表示).
(3)下列情况能说明反应②已达平衡状态的是(填编号).
A.单位时间内生成1mol NO2的同时消耗了lmol NO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,NO的体积分数保持不变
(4)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线.试分析实际化工生产中不采用高压的原因 .
(5)探究反应④中平衡时CO2的体积分数与反应物中 ![]() 的比值、温度的关系,得到如图2所示的曲线.
的比值、温度的关系,得到如图2所示的曲线.
①在X、Y、Z三点中,CO的转化率从大到小的顺序是 .
②若保持其他条件不变,请在图2中,画出温度为T2(T2<T1)时的变化趋势曲线.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com