
【题目】设NA为阿伏伽德罗常数的值,下列叙述错误的是( )
A.1.8g18O2分子与1.8g18O3分子中含有的中子数不同
B.7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA
C.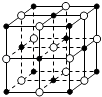 23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
D.含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA
【答案】A
【解析】解:A、18O2分子与18O3均由氧原子构成,故1.8g18O2分子与1.8g18O3中含有的18O的物质的量相同,均为0.1mol,则含有的中子数均为NA个,故A错误;
B、Na2S和 Na2O2的摩尔质量均为78g/mol,且均由2个钠离子和1个阴离子构成,故7.8gNa2S和 Na2O的物质的量均为0.1mol,其含有的阴离子均为0.1NA个,故B正确;
C、质量换算物质的量,结合一个晶胞含4个NaCl,23.4 g NaCl晶体物质的量= ![]() =0.4mol;所以含0.1 NA个如图所示结构单元,故C正确;
=0.4mol;所以含0.1 NA个如图所示结构单元,故C正确;
D、含16 g氧原子的二氧化硅的物质的量为 ![]() =0.5mol,根据1mol二氧化硅中含4molSi﹣Oδ键可知,0.5mol二氧化硅晶体中含有的δ键数目为2NA,故D正确;
=0.5mol,根据1mol二氧化硅中含4molSi﹣Oδ键可知,0.5mol二氧化硅晶体中含有的δ键数目为2NA,故D正确;
故选A.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 12C和14C互为同素异形体
B. 金刚石和C60互为同位素
C. CH3-CH2-CH2-CH3和![]() 互为同分异构体
互为同分异构体
D. C2H2和C6H6互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)是一种重要的化工原料,工业上可以直接氧化PCl3制备POCl3,反应原理为:P4(白磷)+6Cl2=4PCl3 2PCl3+O2=2POCl3
PCl3、POCl3的部分性质如下:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl |
某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去) :
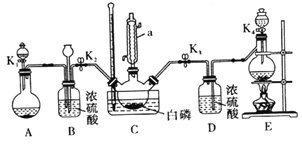
(1)仪器a 的名称为_______________,B装置中长颈漏斗的作用是___________________。
(2)装置E用来制取Cl2,反应的离子方程式为_____________________。
(3)为使实验顺利进行,还需补充的装置为____________________。
(4)反应时,需严格控制三个条件:
①先制取___________,缓慢地通入C 中,直至C 中的白磷消失后,再通入另一种气体。
②C装置用水浴加热控制温度为60 ℃~65℃,除加快反应速率外,另一目的是___________________。
③反应物必须干燥,否则会在C 装置中产生大量的白雾,其主要成分为___________(写化学式)。
(5)反应结束后通过下面步骤测定POCl3产品中Cl 的含量,元素Cl 的质量分数为_______________(写出计算式)。
Ⅰ.取xg产品于锥形瓶中,加入足量NaOH 溶液,POCl3完全反应后加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入0.1000 mol/L 的AgNO3 溶液40.00 mL,使Cl-完全沉淀;
Ⅲ.再向锥形瓶中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;
Ⅳ.然后加入指示剂,用c mol/LNH4SCN溶液滴定过量Ag+ 至终点,记下所用体积为VmL。
(己知:AgPO4溶于酸,Ksp(AgCl )=32×10-10,Ksp(AgSCN )=2×10-12)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥主要成分是MgO(占40%),还含有Na2B4O7、CaO、Al2O3、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取MgSO4·7H2O的工艺流程如下:
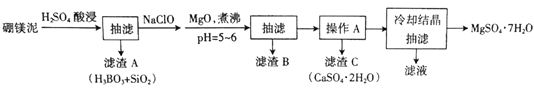
已知部分金属阳离子沉淀的pH:Fe(OH)3:3.2,Al(OH)3:5.2,Fe(OH)2:9.7,Mg(OH)2:11.2。
(1)为提高酸浸时浸出速率,可采取的措施有______________(写出两条)。
(2)H2SO4和Na2B4O7发生反应的化学方程式为________________。
(3)加入NaClO后可以生成一种不溶于水的黑色固体,则反应的离子方程式为_________。
(4)加MgO煮沸,并调整溶液pH=5~6的目的是_______________。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 10℃ | 20℃ | 40℃ | 60℃ |
MgSO4 | 28.2 | 33.7 | 44.5 | 54.6 |
CaSO4 | 0.244 | 0.255 | 0.264 | 0.265 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4。除去,根据上表数据,步骤为________________,__________________。
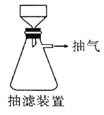
(6)本实验中多次用到抽滤操作,其装置如图,相比普通过滤,抽滤的优点是____________________。
(7)实验中提供的硼镁泥共100g,得到MgSO4·7H2O为172.2g,则MgSO4·7H2O的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一温度下,某一密闭容器中,M、N、R三种气体浓度的变化如图a所示,若其它条件不变,当温度分别为T1和T2时,N的体积分数与时间关系如图b所示.则下列结论正确的是( ) 
A.该反应的热化学方程式M(g)+3N(g)2R(g)△H>0
B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
C.达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小
D.达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如下图所示,其中W的最高正价和最低负价的代数和为2。下列判断正确的是( )
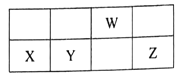
![]()
A. 最高价氧化物对应水化物的酸性:Y>W
B. 最简单气态氢化物的稳定性:Z>Y
C. 元素W与元素Y形成的化合物Y3W4是一种新型有机材料
D. X的单质能与W的最高价氧化物对应水化物的浓溶液反应产生氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、Si02、A12O3),不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如图流程:
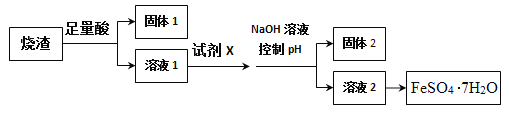
已知,某些金属阳离子可以通过“控制pH”[既调节溶液的酸碱性,pH=-lgc(H+)),pH值越大,碱性越强]使其转化为沉淀。固体2为白色沉淀。
(1)加足量酸之前,烧渣需经过进一步粉碎处理,粉碎的目的是__________。
(2)溶解烧渣选用的足量酸能否是盐酸,并说明理由_____。
(3)固体1有诸多用途,请列举其中一个____,试剂X的作用是______。
(4)某同学在控制pH这步操作时不慎将氢氧化钠溶液加过量了,结果得到的白色沉淀迅速转化为灰绿色,最终变为红褐色沉淀。请用化学用语解释固体2白色变成红褐色的原_____________。
(5)从溶液2中得到绿矾的过程中除需控制温度,防止产品分解外还应注意______。
(6)唐代苏敬《新修本草》对绿矾有如下描述:“本来绿色,新出窑未见风者,正如琉璃。陶及今人谓之石胆,烧之赤色。”另已知1mol绿矾隔绝空气高温煅烧完全分解,转移NA个电子。试写出绿矾隔绝空气高温煅烧分解的化学反应方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com