
| A. | Q1=Q2 | B. | Q1>Q2 | C. | Q1<Q2 | D. | 无法判断 |
 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:选择题
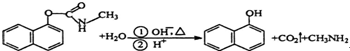
| A. | 西维因是一种芳香烃 | |
| B. | 西维因分子中所有碳原子一定共面 | |
| C. | 可用FeCl3溶液检验西维因是否发生水解 | |
| D. | 在Ni催化加热条件下西维因不能与H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
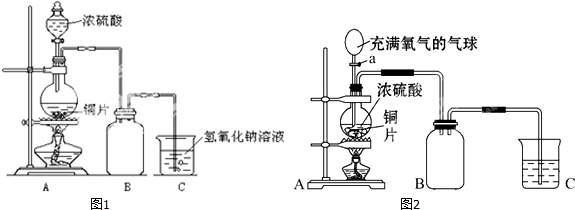
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
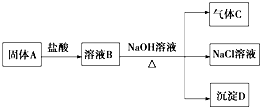
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(3d)>E(4s) | D. | E(5s)>E(4s)>E(4f) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
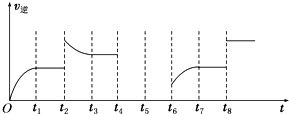 丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.
丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.| 容器 编号 | 起始时各物质 的物质的量/mol | 达到平衡 的时间/min | 达到平衡时 体系能量的 变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| A | 1.5 | 1.9 | 0 | 0 | ta | 放出热量:36.9 |
| B | 3 | 3.8 | 0 | 0 | tb | 放出热量:Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述元素中,Y的原子半径最大 | |
| B. | 上述元素中,W的气态氢化物最稳定 | |
| C. | 元素W和X可形成含有极性键的极性分子WX3 | |
| D. | 工业上可用电解熔融的Y、Z的化合物的方法冶炼Y、Z的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com