

分析 (1)①断裂化学键吸收能量,形成化学键放出能量;
②反应A中,4mol HCl被氧化,放出115.6kJ的热量,依据热化学方程式书写方法,标注物质聚集状态和对应焓变写出;
③依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,焓变=反应物断键吸收热量-生成物形成化学键放出热量计算;
(2)①由图可知,当HCl的转化率相同时,温度由低到高对应的投料比为4:1、2:1、1:1,由此可确定温度与投料比的关系;
②依据化学平衡三段式列式计算得到;
解答 解:(1)①断裂化学键吸收能量,拆开化学键需要吸收热量,
故答案为:吸收;
②依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
故答案为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
③断开1mol H-O键与断开1mol H-Cl键所需能量依据焓变=反应物断键吸收热量-生成物形成化学键放出热量计算,
4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
4×H-Cl+498-(243×2+4×H-O)=-115.6,得到4×H-O-4×H-Cl=498-486+115.6=127.6
(H-O)-(H-Cl)=31.9≈32,H2O中H-O键比HCl中H-Cl键强,
故答案为:32;强;
(2)①在其他条件不变时,O2的量越大,HCl的转化率越大,由此可确定a为6:1,b为4:1,c为2:1,d为1:1,故答案为:4:1;
②由图可读出投料比为2:1、温度为400℃时,HCl的转化率为80%,设投入的HCl为2 mol,O2为1 mol,由此可建立三段式:
4HCl+O2=2Cl2+2H2O
n(起始)/mol 2 1 0 0
n(转化)/mol 1.6 0.4 0.8 0.8
n(平恒)/mol 0.4 0.6 0.8 0.8
所以平衡混合气中Cl2的物质的量分数=$\frac{0.8mol}{0.4mol+0.6mol+0.8mol+0.8mol}$×100%=30.8%,
故答案为:30.8%.
点评 本题考查热化学方程式、热化学方程式书写,化学键键能和焓变关系计算,图象分析判断、化学反应转化率计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | c (Na+)═c(CH3COO-)+c(CH3COOH) | B. | c(H+)═c(CH3COO-)+c(OH一) | ||
| C. | c (Na+)>c (CH3COO-)>c(OH-)>c(H+) | D. | c (CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: | |
| B. | NH4Cl的电子式: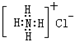 | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}O$ | |
| D. | Cr原子的电子排布式:[Ar]3d44s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C2H6 | C. | C3H6 | D. | C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使燃料充分燃烧 | B. | 合理使用能源 | ||
| C. | 加强能源利用的科技投入 | D. | 加大能源开采力度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe→Fe2++2e- | B. | 2H++2e-→H2↑ | ||
| C. | 4OH-→2H2O+O2↑+4e- | D. | 2H2O+O2+4e-→4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com