
| A、将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后,混合液pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
| B、pH均为9的三种溶液:CH3COOH、Na2CO3、NaOH,其物质的量浓度的大小顺序是NaOH 溶液>CH3COOH溶液>Na2CO3溶液 |
| C、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+) |
| D、0.2mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合:c(H+)=c(OH-)+c(HCO3-)+2c(H2CO3) |


科目:高中化学 来源: 题型:
| A、pH值升高 |
| B、c(H+)和c(OH-)的乘积增大 |
| C、酸性增强 |
| D、OH-离子浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ?mol-1 | a | b | c | d | e |
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 数值 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属X能与NaOH溶液反应放出H2,但金属Y不能,则Y的金属性一定比X弱 |
| B、在合成氨反应达到平衡时,只增加N2的物质的量,达新平衡后N2的百分含量增大 |
| C、在铁件上镀铜时,铁和电源负极相连,铜和正极相连,电解质溶液是CuSO4溶液 |
| D、Cl2和SO2等体积充分混合后,通入品红溶液,溶液颜色没有明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,18g H2O中含H2数目为NA |
| B、标准状况下,22.4L H2O中含有化学键的数目为2NA |
| C、将0.5mol SO2通入足量水中,充分反应后可得到H2 SO3分子数为0.5NA |
| D、常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、塑料垃圾可直接露天焚烧 |
| B、实施“禁塑令”有助于遏制白色污染 |
| C、纤维素、油脂、蛋白质均属于有机高分子 |
D、聚丙烯结构式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、D2O中质子数与中子数 |
| B、Na2O2中的阴,阳离子数 |
| C、SO2与氯水反应生成两种强酸的反应中,氧化剂与还原剂 |
| D、沸水时纯水中H+与OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为
C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为 ,其中R、R′为烃基.请回答以下问题:
,其中R、R′为烃基.请回答以下问题: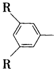 ,且属于酯的所有同分异构体的结构简式
,且属于酯的所有同分异构体的结构简式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com