
| A、m=n | B、m>n |
| C、m<n | D、无法确定 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、K+ Na+ SO42- Cl- |
| B、K+ Na+ S2- NO3- |
| C、Mg2+ NH4+ SO42- Cl- |
| D、K+ Na+ AlO2- ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行蒸发操作时,当有大量晶体析出,就应停止加热 |
| B、进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、进行萃取操作时,应选择有机萃取剂,如可用酒精萃取溴水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:
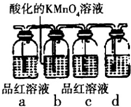 掌握物质之间的转化,是学习元素化合物知识的基础.
掌握物质之间的转化,是学习元素化合物知识的基础.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应中NH3被还原 |
| B、该反应中H-是还原剂 |
| C、该反应中NH2-是还原产物 |
| D、反应中被氧化和被还原的元素都是H元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使压强增大 |
| B、恒容,充入N2 |
| C、恒容,充入He气 |
| D、恒压,充入He气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500mL 1mol/L的KNO3溶液 |
| B、500mL 1mol/L的Ba(NO3)2溶液 |
| C、1000mL 0.5mol/L的Mg(NO3)2溶液 |
| D、1L 0.5mol/L的Fe(NO3)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1L该溶液中含有NaOH 4.0g |
| B、100 mL该溶液中含有OH-0.01mol |
| C、从1L该溶液中取出100mL,所取出的NaOH溶液的浓度为0.01 mol?L-1 |
| D、在1 L水中溶解4g NaOH即可配制得0.1 mol?L-1NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com