
| A. | CH3F的电子式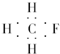 | B. | Na2S的电子式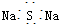 | C. | 氢氧根的电子式 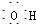 | D. | 次氯酸的电子式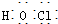 |
分析 A、F也满足8最外层8个电子的稳定结构;
B、硫化钠中存在钠离子和硫离子,钠离子直接用离子符号表示,硫离子需要标出最外层电子及所带电荷;
C、氢氧根离子为阴离子,需要标出所带电荷;
D、氯原子最外层有7个电子,形成1个共价键,氧原子最外层有6个电子,形成2个共价键.
解答 解:A、CH3F中F也应满足8个电子的稳定结构,其最外层电子不能省略,正确电子式应为: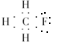 ,故A错误;
,故A错误;
B、Na2S为离子化合物,钠离子用离子符号表示,硫离子标出最外层电子,硫化钠的电子式为: ,故B错误;
,故B错误;
C、氢氧根离子带有1个单位负电荷,其正确的电子式为: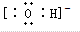 ,故C错误;
,故C错误;
D、氯原子最外层有7个电子,氧原子最外层有6个电子,在次氯酸中,氯原子与氧原子形成1对共用电子对,氢原子与氧原子形成1对共用电子对,都达稳定结构,电子式为 ,故D正确,故选D.
,故D正确,故选D.
点评 考查常用化学用语的书写,难度不大,注意D中次氯酸电子式的书写容易受分子式影响.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3所含的分子数目为NA | |
| B. | 0.2molH2O2催化分解,转移电子数为0.2NA | |
| C. | 0.1mol/L的100mLH2SO3溶液中,含有的离子数约为0.03NA | |
| D. | 6.25 mL1 mol/L浓硫酸与足量铜反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
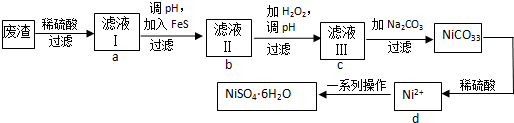
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它极易溶于水,是因为它与水分子间容易形成氢键,它与W元素的氢化物反应形成的化合物属于离子晶体;
,它极易溶于水,是因为它与水分子间容易形成氢键,它与W元素的氢化物反应形成的化合物属于离子晶体;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
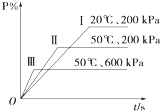 在一密闭容器中进行以下可逆反应:M(g)+P(g)═N(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则该反应( )
在一密闭容器中进行以下可逆反应:M(g)+P(g)═N(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则该反应( )| A. | 正反应放热,L是固体 | B. | 正反应吸热,L是气体 | ||
| C. | 正反应吸热,L是固态 | D. | 正反应放热,L是固体或气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.4KJ | B. | 350KJ | C. | 3.5KJ | D. | 8.5KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L辛烷的分子数为NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为 NA | |
| D. | 28gC2H4所含共用电子对数目为6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com