
| A、铁分别加入浓硫酸和氢氧化钠溶液中均无明显现象 |
| B、H2O2溶液中加入MnO2或FeCl3溶液都能增大反应速率 |
| C、漂白粉溶液和硅酸钠溶液久置空气中都变质 |
| D、SO2既能使品红褪色也能使酸性高锰酸钾褪色 |


科目:高中化学 来源: 题型:
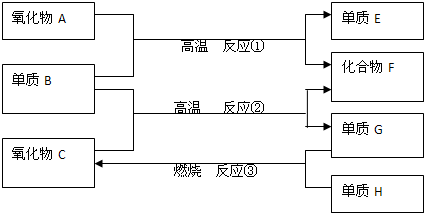
查看答案和解析>>
科目:高中化学 来源: 题型:
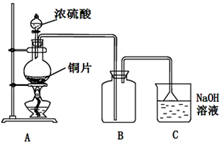 I.Fe2+和I-是两种常见的还原性离子.
I.Fe2+和I-是两种常见的还原性离子.| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水. | 溶液变成黄色 |
| 步骤2: |
| 序号 | 不合理的原因 | 误差 (偏低或偏高) |
改变措施 |
| 方案① | |||
| 方案② |
查看答案和解析>>
科目:高中化学 来源: 题型:
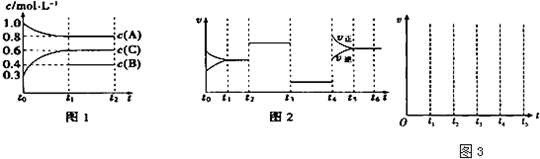
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 |
| B、混入Cl2中的HCl气体,可用饱和NaCl溶液除去 |
| C、除去Fe粉中的少量铝粉:加入NaOH溶液后过滤 |
| D、提取溶解在水中的少量溴:加入CCl4,振荡,静置,分层后,取出有机层再分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有②③ |
| B、只有②③⑤ |
| C、只有①②③④ |
| D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正极反应式为:O2+2H2O+4e-=4OH- |
| B、工作一段时间后,电解液中KOH的物质的量不变 |
| C、该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D、用其作电源电解精炼铜时,纯铜作阳极,而在镀件上电镀铜时金属铜作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
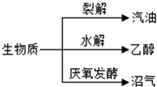 生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如图转化.下列说法不正确的是( )
生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如图转化.下列说法不正确的是( )| A、沼气的主要成分是甲烷 |
| B、汽油属于一次能源 |
| C、乙醇属于可再生能源 |
| D、生物质能来源于太阳能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com