
 某兴趣小组的同学用如图所示装置研究有关电化学的问题,当闭合该装置的电键时,观察到电流计的指针发生了偏转.
某兴趣小组的同学用如图所示装置研究有关电化学的问题,当闭合该装置的电键时,观察到电流计的指针发生了偏转.
| ||
| ||
| 5.4g |
| 108g/mol |
| 0.05 |
| 4 |
| 0.05 |
| 2 |


科目:高中化学 来源: 题型:
| A、自行车钢架生锈主要是电化学腐蚀所致 |
| B、利用垃圾发电能达到节能减排的目的 |
| C、人们用明矾对水进行消毒、杀菌 |
| D、食用一定量的油脂能促进人体对某些维生素的吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:

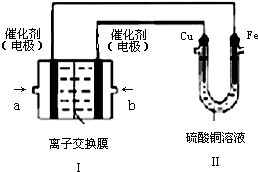
查看答案和解析>>
科目:高中化学 来源: 题型:
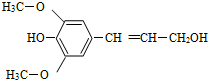 膳食纤维具有的突出保健功能,近年来受到 人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有的突出保健功能,近年来受到 人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )| A、芥子醇的分子式是C11H12O4 |
| B、芥子醇分子中所有碳原子不可能在同一平面 |
| C、1mol芥子醇能与足量溴水反应消耗3molBr2 |
| D、1mol芥子醇与足量的氢气反应消耗氢气4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- |
| B、加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- |
| C、c(Fe3+)=0.1mol?L-1的溶液:H+、Al3+、I-、SCN- |
| D、常温下pH=12的溶液:Na+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、维生素C可将 Fe2+还原成为Fe3+ |
| B、亚硝酸盐被氧化 |
| C、亚硝酸盐是氧化剂 |
| D、维生素C是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素A、B、C、D、E在元素周期表中的位置如图所示,B是形成化合物种类最多的元素.
短周期元素A、B、C、D、E在元素周期表中的位置如图所示,B是形成化合物种类最多的元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3 |
| B、K2CO3、Na2CO3 |
| C、NaOH、K2CO3 |
| D、K2CO3、NaOH、Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com