
| A. | 原子序数a>b>c>d | |
| B. | 离子半径D(n+1)->Cn->An+>B(n+1)+ | |
| C. | 单质还原性A>B>C>D | |
| D. | 最高价氧化物对应水化物的碱性B>A |
分析 已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,结合元素周期律递变规律解答该题.
解答 解:已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,则
A.由以上分析可知原子序数:b>a>c>d,故A错误;
B.aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,核电荷数越大离子半径越小,核电荷数b>a>c>d,故离子半径D(n+1)->Cn->An+>B(n+1)+,故B正确;
C.C、D在同一周期,且原子序数C>D,非金属性:C>D,元素的非金属性越强,对应的单质的还原性越弱,故C错误;
D.A、B在周期表中同周期,原子序数:b>a,金属性:A>B,最高价氧化物对应水化物的碱性:A>B,故D错误.
故选B.
点评 本题考查位置结构性质的相互关系及应用,为高考常见题型,根据核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
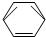 -CH2CH3$\stackrel{酸性KMn_{4}O_{2}溶液}{→}$C6H5-COOH
-CH2CH3$\stackrel{酸性KMn_{4}O_{2}溶液}{→}$C6H5-COOH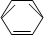 +HNO3 $→_{55~60℃}^{浓硫酸}$C6H5NO2 +H2O
+HNO3 $→_{55~60℃}^{浓硫酸}$C6H5NO2 +H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热CS2CO3可生成CS2O和CO2(CS:铯 IA) | |
| B. | 铊(Tl)与铝同族,其单质既能与HCl又能与NaOH溶液反应 | |
| C. | AgAt为白色沉淀,不溶于稀HNO3(At:砹 VⅡA) | |
| D. | Ra(OH)2是易溶于水的强碱(Ra:镭ⅡA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表是元素周期律的具体表现形式 | |
| B. | 元素的性质随原子序数递增而呈现周期性变化的根本原因是随原子序数的递增原子的核外电子排布呈现周期性变化 | |
| C. | 同周期第IA族与第VA族原子序数之差可能是4、14、28 | |
| D. | 同主族原子序数之差不可能是:10、16、18、26、34、36、50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
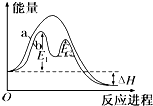
| A. | 改变催化剂,可改变该反应的活化能 | |
| B. | 该反应为吸热反应,热效应等于△H | |
| C. | 反应过程a有催化剂参与 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
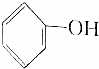 >HCO3-,下列化学方程式不正确的是( )
>HCO3-,下列化学方程式不正确的是( )| A. | 2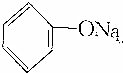 +H2O+CO2→2 +H2O+CO2→2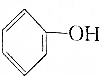 +Na2CO3 +Na2CO3 | B. | 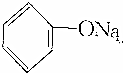 +H2O+CO2→ +H2O+CO2→ +NaHCO3 +NaHCO3 | ||
| C. |  +Na2CO3→ +Na2CO3→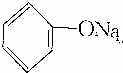 +NaHCO3 +NaHCO3 | D. | 2 +2Na→2 +2Na→2 +H2↑ +H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
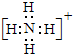
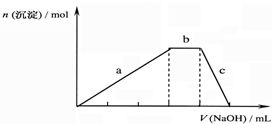
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com