
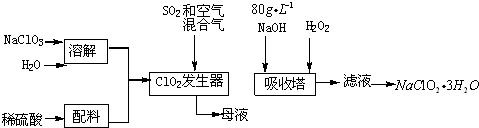
分析 根据流程可知,氯酸钠(NaClO2)在酸性条件下被二氧化硫还原成二氧化氯,ClO2在二氧化硫和空气混合气体中不易分解爆炸,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2•3H2O,
(1)浓度g/L表示1L溶液中所含溶质质量的多少.80g/LNaOH溶液表示1L氢氧化钠溶液含有80gNaOH.令溶液体积为1L,计算氢氧化钠的物质的量.利用c=$\frac{n}{V}$计算氢氧化钠溶液的物质的量浓度;
(2)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.据此解答;
(3)根据题目信息并运用氧化还原反应理论判断反应物、生成物;
(4)根据流程信息可知,吸收塔内生成ClO2,一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生.据此书写方程式,温度过高,H2O2容易分解;
(5)NaOH过量则溶液呈碱性,但考虑到该溶液有强氧化性,选择指示剂或pH试纸检验会遇到氧化褪色问题,故工业生产中主要是用pH计连续测定溶液pH;
(6)还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产.Na2O2溶于水相当于H2O2;
(7)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.
解答 解:(1)浓度g/L表示1L溶液中所含溶质质量的多少.80g/LNaOH溶液表示1L氢氧化钠溶液含有80gNaOH.令溶液体积为1L,则80gNaOH的物质的量为$\frac{80g}{40g/mol}$=2mol.所以该溶液氢氧化钠的物质的量浓度c(NaOH)=$\frac{2mol}{1L}$=2mol/L,
故答案为:2mol/L;
(2)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.发生器中鼓入空气的作用应是稀释ClO2以防止爆炸,
故选:c;
(3)根据流程信息可知,发生器内生成ClO2,所以一定有NaClO3→ClO2化合价降低,被还原,则二氧化硫被氧化成硫酸钠,反应的方程式为:2NaClO3+SO2=2ClO2↑+Na2SO4,ClO2进入吸收塔,则硫酸钠留在母液中,故从母液中可回收硫酸钠,
故答案为:Na2SO4;
(4)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2;H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过20℃,其目的是防止H2O2分解,
故答案为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;防止H2O2分解;
(5)NaOH过量则溶液呈碱性,但考虑到该溶液有强氧化性,选择指示剂或pH试纸检验会遇到氧化褪色问题,故生产中主要是用pH计连续测定溶液pH,
故答案为:连续测定吸收塔内溶液的pH;
(6)还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产.Na2O2溶于水相当于H2O2,Na2S、FeCl2还原性较强,生成物与NaClO2分离比较困难,
故选:b;
(7)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.所以操作顺序为a、e、c,
故答案为:a、e、c.
点评 本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考察学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力.题目有一定的难度.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气中PM2.5微米以下的颗粒物的存在一定能够形成丁达尔效应 | |
| B. | 煤燃烧时加入少量的生石灰可以减少废气中的二氧化硫排放 | |
| C. | 将造纸废水通过高压水井压到地下,节约成本 | |
| D. | 聚乙烯塑料的老化是由于发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀. | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色. | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗酸性KMnO4溶液的体积/mL | 19.10 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
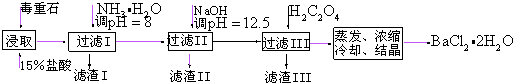
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W | |
| T |
| A. | Mg在一定条件下可以和YX2发生反应生成Y单质 | |
| B. | 化合物YX2、ZX2化学键类型和晶体类型均相同 | |
| C. | Z、W、T三种元素最高价氧化物的水化物的酸性依次增强 | |
| D. | 五种元素中,只有T是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
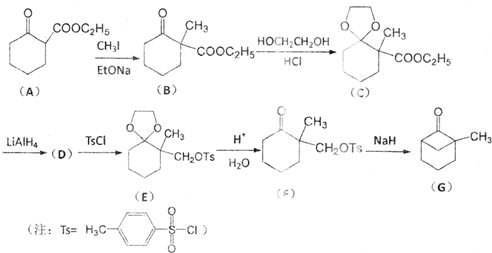
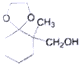 ;
; )、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(
)、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(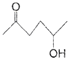 )的合成路线流程图(有机溶剂乙醚和无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH
)的合成路线流程图(有机溶剂乙醚和无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH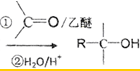
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com