
【题目】下列粒子中,与NH4+具有相同质子数和电子数的是
A. OH— B. F- C. Na+ D. NH3
科目:高中化学 来源: 题型:
【题目】近年来,环境问题越来越引起人们的重视。温室效应、酸雨、臭氧层被破坏、赤潮等已经给我们赖以生存的环境带来较大的影响,造成酸雨的主要有害物质是
A. CO2B. 硫和氮的氧化物
C. 含氟化合物D. 化肥和含磷洗衣粉的使用及其污水的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用甲烷和氧气按9:1的体积比混合,在200℃和10MPa的条件下,通过铜制管道反应制得甲醇:2CH4+O2=2CH3COH。
(1)已知一定条件下,CH4和CH3COH燃烧的热化学方程式分别为:
CH4(g)+SO2(g)=CO2(g)+2H2(g) △H=-802kJ/lmol
CH3OH(g)+l.5O2(g)=CO2(g)+2H2O(g) △H=-677kJ/mol
则2CH4(g)+O2(g)=2CH3OH(g) △H=__________
(2)甲烷固体氧化物燃料电池属于第三代燃料电池,是一种在中高温下直接将储存在燃料和氧化剂中的化学能高效、环境友好地转化成电能的全固态化学发电装置。其工作原理如下图所示。a是电池的____极(填“正”或“负”) ,b极的电极反应式为__________。

(3)工业上合成甲醇的另一种方法为:
CO(g)+2H2(g) ![]() CH3OH(g) △H=-90kJ/mol
CH3OH(g) △H=-90kJ/mol
T℃时,将2mol CO 和4molH2充入1L 的密闭容器中,测得H2的物质的量随时间变化如下图实线所示。
① 能用于判断反应已达化学平衡状态的是____________。
A.气体的总压强不再改变
B. H2与CH3OH的体积比不再改变
C.气体的密度不再改变
D.单位时间内消耗1mol CO,同时生成1mol CH3OH
② 请计算出T℃ 时反应的平衡常数K=_________________。
③ 仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅰ对应的实验条件改变是:________;曲线Ⅱ对应的实验条件改变是_________0。

④ a、b、c三点逆反应速率由大到小排列的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某第三周期金属元素R的部分电离能情况如图Ⅰ所示,则R元素位于正确表第____族,其基态原子第二能层电子排布图为_____________________。
图Ⅱ中 A、B、C、D是四种不同主族元素的气态氢化物,其中A比B分子沸点高的可能原因是_________。

图Ⅱ中C物质能与第二周期中的另一种元素的氢化物通过配位键相互作用得到化合物X,X是一种储氢材料,且X是乙烷的等电子体,加热X会缓慢释放H2同时生成化合物Y,Y又是乙烯的等电子体,则化合物C的VSEPR模型是__________,X的结构式为__________(标明配位键)。
(2)已知Ti3+可形成配位数为6的配合物。
现有钛的两种配合物,组成皆为TiCl3·6H2O,一种为紫色,另一种为绿色,现取等质量的两种物质的样品配成待测溶液,分别往待测溶液中滴入AgNO3溶液充分反应,产生白色沉淀;测得绿色物质得到的沉淀质量是紫色物质得到的沉淀质量的2/3。则原绿色配合物的化学式为_____________,原紫色配合物的化学式为_____________。
(3)由某原子构成的晶胞,己知晶胞密度为ρg/cm3,边长为anm。若该原子半径为(![]() )anm,则该晶胞类型为______________;该原子的摩尔质量表达式为______________。
)anm,则该晶胞类型为______________;该原子的摩尔质量表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol·L-1HA溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法错误的是

A. HA的电离方程式为HA![]() H++A-
H++A-
B. HA完全反应时,溶液所对应的点位于c和d之间
C. 滴定到c点时:c(Na+)>c(A-)>c(H+)=c(OH-)
D. 滴定到d点时:n(Na+)+n(H+)-n(OH-)+n(HA)=0.002mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应:H2(g)+I2(g)![]() 2HI(g),达到化学平衡状态的标志是( )
2HI(g),达到化学平衡状态的标志是( )
A. 正、逆反应速率都等于零 B. H2、I2的浓度相等
C. HI、H2、I2在容器中共存 D. HI、H2、I2的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1molN2O4充入容积固定为2 L的密闭容器中,发生反应:N2O4![]() 2NO2(g)。经2s达到化学平衡状态,此时测得容器中c(NO2)=0.2mol/L。
2NO2(g)。经2s达到化学平衡状态,此时测得容器中c(NO2)=0.2mol/L。
(1)下列说法中,一定能说明该反应达到平衡状态的是_________(填序号)。
A.正、逆反应均已停止 B. v(NO2)=2v(N2O4)
C.容器中 c(NO2) : c(N2O4)=2∶1 D.混合气体的密度不变
E.混合气体的压强不变 F.混合气体的颜色不变
(2)0~2 s内反应的平均速率v(NO2)=___________________。
(3)达到平衡时容器中c(N2O4)=______________________。
(4)达到平衡时,N2O4转化率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,图2是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA- ,Ⅲ代表A2-,下列说法正确的是( )
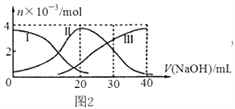
A. H2A在水中的电离方程式是:H2A═2H++A2-
B. 当V(NaOH)=40mL时,其溶液中水的电离受到抑制
C. 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
D. 当V(NaOH)=30mL时,则有:c(H+) +c(Na+)═ c(A2-)+ c(OH-)+ c(HA-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com