
| A. | 物质的量浓度相等的碳酸氢钡溶液和氢氧化钠溶液等体积混合Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O | |
| B. | NaHSO4溶液中滴加入Ba(OH)2溶液至中性:2H++Ba2++2OH-+SO42-=BaSO4↓+2H2O | |
| C. | 以石墨作电极电解氯化镁溶液:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| D. | 碳酸氢钠溶液加入氯化铝溶液 3HCO3-+Al3+?3CO2↑+Al(OH)3↓ |
分析 A.物质的量浓度相等的碳酸氢钡溶液和氢氧化钠溶液等体积混合,反应的n(HCO3-):n(OH-)=1:1,氢氧化钠不足;
B.NaHSO4溶液中滴加入Ba(OH)2溶液至中性,生成硫酸钡沉淀和水;
C.电解氯化镁溶液生成氢气、氯气和氢氧化镁沉淀;
D.碳酸氢钠溶液加入氯化铝溶液发生互促水解,比较彻底.
解答 解:A.物质的量浓度相等的碳酸氢钡溶液和氢氧化钠溶液等体积混合,应满足n(HCO3-):n(OH-)=1:1,离子方程式为Ba2++HCO3-+OH-=BaCO3↓+H2O,故A错误;
B.NaHSO4溶液中滴加入Ba(OH)2溶液至中性,生成硫酸钡沉淀和水,为2H++Ba2++2OH-+SO42-=BaSO4↓+2H2O,故B正确;
C.电解氯化镁溶液生成氢气、氯气和氢氧化镁沉淀,为Mg2++2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$-H2↑+Cl2↑+Mg(OH)2↓,故C错误;
D.碳酸氢钠溶液加入氯化铝溶液发生互促水解,比较彻底,不用可逆符号,应为3HCO3-+Al3+=3CO2↑+Al(OH)3↓,故D错误.
故选B.
点评 本题考查了离子方程式正误判断,为考试热点,难溶物、弱电解质、氧化物、气体、络合物等都要写化学式,要注意遵循转移电子守恒、原子守恒及电荷守恒,题目难度不大.


 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题:
表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题: | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑨ | ⑥ | ⑦ | ⑧ |
 ,该物质与溴水发生加成反应的化学方程式是CH2=CH2+Br2→BrCH2CH2Br.
,该物质与溴水发生加成反应的化学方程式是CH2=CH2+Br2→BrCH2CH2Br.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ Na+ S2- Cl- | B. | Al3+ NH4+ AlO2- NO3- | ||
| C. | NH4+ Mg2+ SO42- Cl- | D. | H+ Na+ HCO3- SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
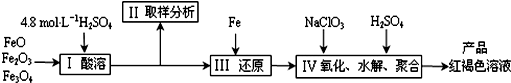
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室蒸馏自来水得到少量蒸馏水的装置示意图如图2,请根据图示回答下列问题:
如图为实验室蒸馏自来水得到少量蒸馏水的装置示意图如图2,请根据图示回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com