
【题目】下列实验操作对应的实验现象及解释或结论都正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色 | 氧化性:H2O2>Fe3+ |
B | 向5mL1mol/L NaOH溶液中滴加5滴1mol/L MgCl2溶液,然后再滴加足量的1mol/L CuCl2溶液 | 先产生白色沉淀,然后产生蓝色沉淀 | Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 2NO2(g) |
D | 向一定量酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH) | 溶液紫色褪去 | 乙二醇被氧化为乙二酸 |
A. A B. B C. C D. D
【答案】C
【解析】分析:A. Fe(NO3)2溶液中滴入硫酸,会形成HNO3,因此溶液变为黄色,有可能是HNO3氧化Fe2+; B.溶度积常数大的物质能转化为溶度积小的物质;C. 升高温度,可逆反应向吸热反应方向移动;D. KMnO4与乙二醇(HOCH2CH2OH)发生氧化还原反应生成二氧化碳,且高锰酸钾可氧化乙二酸。
详解:A. Fe(NO3)2溶液中滴入硫酸,会形成HNO3,因此溶液变为黄色,有可能是HNO3氧化Fe2+,结论错误,故A错误;
B.溶度积常数大的物质能转化为溶度积小的物质,根据现象知,Ksp[Cu(OH)2]
<Ksp[Mg(OH)2],结论错误,故B错误;
C. 升高温度,可逆反应向吸热反应方向移动,升高温度气体颜色加深,说明平衡向生成二氧化氮方向移动,所以正反应是放热反应,所以C选项是正确的;
D. KMnO4与乙二醇(HOCH2CH2OH)发生氧化还原反应生成二氧化碳,且高锰酸钾可氧化乙二酸,结论不合理,所以D选项是错误的。
答案选C。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】现有浓度均为1 mol·L-1的FeCl3、CuCl2、FeCl2的混合溶液100 mL,向该溶液中加入5.6 g铁粉充分反应(溶液的体积变化忽略不计)。下列有关叙述不正确的是( )
A. 反应后的溶液中含有0.2 mol Fe2+和0.1 mol Cu2+
B. 反应后的溶液中含有Fe2+、Cu2+,不含Fe3+
C. 反应后的溶液中Fe2+的浓度增至3 mol·L-1
D. 反应后残留固体为3.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3S + 6KOH = 2K2S + K2SO3+ 3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是:
A.1∶2B.2∶1C.1∶3D.3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售照明材料LED晶片是一种发光二极管。材质组成为:GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、GaInN(氮化镓铟)等。请回答下列问题:
(1)砷基态原子的核外电子排布式为______________________。
(2)上述非金属元素氢化物的沸点从高到低的顺序为___________。
(3)下列说法正确的是___________
a.电负性:As<Ga b.SiC与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。
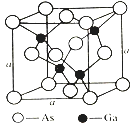
①晶胞中砷与镓原子间的化学键类型有___________。
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是___________。
③一个晶胞的组成为___________。
④已知晶胞棱长a=5.64×10-10m,则该晶胞密度为ρ=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂,一些性质及制备方法如下:
氯化铁:熔点306℃,沸点315℃,易吸收空气中的水分而潮解。工业上采用向500600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。实验室可用下图所示的装置模拟工业生产无水氯化铁,请回答相关问题。

(1)装置A用于KMnO4固体与浓盐酸反应制氯气,反应的离子方程式为______________。
(2)弯曲的a管所起的作用是_____________;装置采用较粗的导管来连接装铁粉的硬质玻璃管和广口瓶C,其目的是____________________。
(3)导管b 口应与 (从虚线框装置中选择装置的字母序号)连接,这样可避免反应系统与环境间的相互影响。
(4)实验完成后,取广口瓶C中收集到的产物进行如下测定分析:
①称取4.52g样品溶于过量的稀盐酸中:②加入足量H2O2;③再加入足量NaOH溶液:④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中Fe元素的质量分数为________%。
(5)由上分析数据和计算得出结论:用此装置制得的无水氯化铁含铁最偏高,显然其中含有较多的FeCl2杂质。
①产生FeCl2杂质的原因是___________________。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组辨析以下说法:①粗盐和酸雨都是混合物;②非金属氧化物一定都是酸性氧化物;③冰和干冰既是纯净物又是化合物;④Na2O、Na2O2都是钠的氧化物,都是碱性氧化物;⑤磷酸和醋酸都是多元酸;⑥纯碱和烧碱都是碱。其中正确的是( )
A.②③⑥B.①②④C.①③D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛戊均为人体必需的短周期非金属元素,在周期表中的相对位置如下表,下列判断正确的是 ( )

A. 非金属性:丙>庚
B. 原子半径:甲>乙
C. 原子最外层电子数:辛>己
D. 最高价氧化物对应水化物酸性:戊>乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com