
【题目】
移取10.00 mL密度为ρg/mL的过氧化氢原溶液稀释成250mL。量取稀过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(1)用高锰酸钾法(一种氧化还原滴定法)可测定待测液中的H2O2的含量。
若需配制浓度为0.10mol·L-1的KMnO4标准溶液500 mL,应准确称取 g KMnO4(已知M(KMnO4)=158.0 g·mol-1)。
a.配制该标准溶液时,下列仪器中不必要用到的有 。(用编号表示)。
①托盘天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
b.定容时仰视读数,导致最终结果____________;(填“偏大”“偏小”或“不变”)
(2)完成并配平离子方程式:
![]() MnO4―+
MnO4―+![]() H2O2+
H2O2+![]() =
=![]() Mn2++
Mn2++![]() O2↑+
O2↑+![]()
(3)滴定时,将高锰酸钾标准溶液注入______________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是___________________。
(4)重复滴定三次,平均耗用 KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为___________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____ _(填“偏高”或“偏低”或“不变”)。
【答案】(1)7.9 ①③ 偏小
(2)2 5 6 H+2 5 8H2O
(3)酸式 滴入最后一滴高锰酸钾溶液,溶液由无色变为浅红色(或紫色),且30秒内不褪色
(4)0.0085v/p (5)偏高
【解析】试题分析:(1)根据公式,m=n×M,n=cV,所以配制浓度为0.10mol·L-1的KMnO4标准溶液500 mL,应准确称取KMnO4的质量为0.10mol·L-1×0.5L×158.0 g·mol-1=7.9g。
(2)方程式中,高锰酸钾有强氧化性,能将双氧水氧化为氧气,锰元素化合价降低了5价,生成1mol氧气时,氧元素化合价升高2价,根据电子转移守恒,配平化学方程式高锰酸根前面的系数为2,双氧水前面的系数为5,根据电荷守恒配平H+前的系数,然后根据原子守恒来配平缺项水前的系数,所以化学方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,答案为2 5 6 H+2 5 8H2O;
(3)由于高锰酸钾标准溶液具有强氧化性,所以只能使用酸式滴定管,滴定到达终点的现象是滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色。
(4)根据化学方程式可以得到关系式:2MnO4-~5H2O2,耗用0.1mol/L KMnO4标准溶液V mL,即V×10-4mol的高锰酸钾时,所用双氧水的物质的量为2.5V×10-4mol,则原过氧化氢的质量为:0.0025Vmol×34g/mol=0.085V,过氧化氢溶液中过氧化氢的质量分数为:0.085V÷(10.00mL×ρg/mL)= 0.0085v/p。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,有一部分溶液占据了气泡的体积,并没有滴入锥形瓶,则测定结果偏高。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】紫菜与海带类似,是一种富含生物碘的海洋植物。商品紫菜轻薄松脆、比海带更易被焙烧成灰实验室里从紫菜中提取碘的流程如下图:
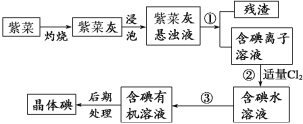
(1)实验室焙烧紫菜,需要下列仪器中的___________(填序号)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①____________,③______________。
(3)提取碘的过程中,可选择的有机试剂是( )
A.酒精 B.苯 C.乙酸 D.食盐水
选择该试剂的理由是_________________________。
(4)为使紫菜灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有______________、________________。
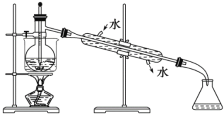
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,观察上面实验装置图改正其中的错误之处:
①_____________________________;
②_____________________________;
③_____________________________。
(6)进行上述蒸馏操作时,使用水浴加热,最后晶态碘在 里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇(CH3OH)是一种重要的化工原料。已知
CH3OH(1) + O2(g) = CO(g) + 2H2O(g) ; △H = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ; △H =-566.00 kJ·mol-1
H2O(1) = H2O (g) ; △H = + 44.00 kJ·mol-1
①试写出能表示CH3OH(1)燃烧热的热化学方程式: 。试利用热化学方程式计算,完全燃烧16g甲醇生成CO2和H2O(l)时,放出的热量为 kJ
②科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池。据此回答下列问题:氧气在 极反应;通入甲醇的电极反应式为_________________
(2)如图所示,800℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图像,回答问题:
①该反应的方程式为 。
②2min内,用B表示的反应速率为 。
③在其他条件下,测得A的反应速率为0.05mol/(L·s),此时的反应与800℃时相比, 。
A.比800℃时快 B.比800℃时慢
C.和800℃时速率一样 D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,mg气体A与ng气体B的分子数相同,下列说法中不正确的是( )
A.两种气体A与B的相对分子质量之比为m:n
B.同质量气体A与B的分子数之比为n:m
C.同温同压下,A、B两气体的密度之比为n:m
D.相同状况下,同体积A、B两气体的质量之比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. C、H、O、N、P、S是蛋白质和核酸共有的化学元素
B. DNA主要位于细胞核中,是细胞核中的遗传物质,RNA是细胞质中的遗传物质
C. 蔗糖和麦芽糖水解的产物都是2分子葡萄糖
D. 胆固醇是构成动物细胞膜的重要成分,还参与血液中脂质的运输
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.催化剂不影响反应活化能,但能增大单位体积内活化分子百分数,从而增大反应速率
B.化学反应速率为0.8 mol/(L·s)是指1 s时某物质的浓度为0.8 mol/L
C.根据化学反应速率的大小可以判断化学反应进行的快慢
D.对于化学反应来说,反应速率越大,反应现象越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:mA(g)+nB(g) ![]() pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是( )
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是( )
A.m+n>p B.平衡向逆反应方向移动
C.A的转化率降低 D.C的浓度增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是 ;装置有一处错误是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50mL0.50mol/LNaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”“偏小”“无影响”)。
(6)为准确测量中和热,若共计做了三次实验,则至少需测定温度 次,三次平行操作测得的数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差为(t2-t1),0.50mol/L盐酸与0.55mol/LNaOH溶液的密度都为1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热的计算式△H= 。(只列出计算表达式,不用计算出最终结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X > Z > W
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 这四种元素的最高化合价分别与其主族序数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com