
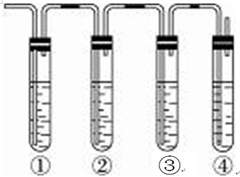
 实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:分析 二氧化硫为酸性气体,可与碱反应,可使品红褪色,具有还原性,可与酸性高锰酸钾发生氧化还原反应,而乙烯含有碳碳双键,能够与酸性高锰酸钾发生氧化还原反应,使高锰酸钾褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,以此解答该题.
解答 解:二氧化硫为酸性气体,可与碱反应,可使品红褪色,具有还原性,可与酸性高锰酸钾发生氧化还原反应,而乙烯含有碳碳双键,能够与酸性高锰酸钾发生氧化还原反应,使高锰酸钾褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,
(1)装置①中盛有品红溶液,用来检验二氧化硫的存在;然后将气体通入盛有氢氧化钠溶液的②除去二氧化硫,再通入盛有品红溶液的③确定二氧化硫是否除干净,最后通入盛有酸性高锰酸钾的④检验乙烯的存在;
故答案为:A;B;A;D;
(2)二氧化硫具有漂白性,能够使品红溶液褪色,故答案为:①中品红溶液褪色;
(3)装置②用来除去SO2气体,以免干扰乙烯的性质实验,故答案为:吸收SO2;
(4)装置③检验SO2是否被除尽,防止干扰乙烯的性质实验,故答案为:检验 SO2 是否被除尽;
(5)装置③中的品红溶液不退色可以排除二氧化硫的干扰,若装置④中的酸性KMnO4溶液退色,可证明乙烯的存在.
故答案为:③中品红溶液不褪色,④中KMnO4溶液褪色.
点评 本题考查物质的性质实验,为高考常见题型,侧重于学生的分析、实验能力的考查,题目着重考查了乙烯的实验室制法以及产物的检验,熟悉二氧化硫、乙烯的性质是解题关键,注意实验设计的严密性,气体检验的顺序,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ①和③ | C. | ②和③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
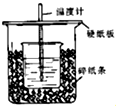 50ml0.50mol/L盐酸和50ml0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50ml0.50mol/L盐酸和50ml0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com