
| A. | 氯仿 | B. | 一氯甲烷 | C. | 一氯乙烷 | D. | 乙醇 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 糖类化合物也可称为碳水化合物 | |
| B. | 维生素D可促进人体对钙的吸收 | |
| C. | 蛋白质是仅由碳、氢、氧元素组成的物质 | |
| D. | 硒是人体必需的微量元素,但不宜摄入过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的溶液中:Fe3+、Mg2+、SCN -、Cl - | |
| B. | c(H+)/c(OH-)=1×10 -12的溶液中:K+、Na+、CO32-、NO3- | |
| C. | c(Fe2+ )=1 mol•L-1的溶液中:K+、NH4+、MnO4-、SO42- | |
| D. | 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol葡萄糖能水解生成2molCH3CH2OH和2molCO2 | |
| B. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| C. | 油脂不是高分子化合物,1mol油脂完全水解生成1mol甘油和3 mol高级脂肪酸(盐) | |
| D. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
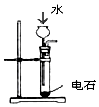 |  | 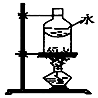 |  |
| 制乙炔的发生装置 | 蒸馏时的接收装置 | 分离固体氯化钠和碘单质 | 准确量取一定体积K2Cr2O7标准溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象及结论 |
| A | 将AlC13溶液加热蒸干 | 得到白色固体,成分为纯净的AlC13 |
| B | 将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液 | 有白色沉淀产生,则Na2SO3己变质 |
| C | 用量筒量取一定体积的浓硫酸时,仰视读数 | 所量取的浓硫酸体积偏大 |
| D | 向FeI2溶液中通入少量C12 | 溶液变黄,则C12的氧化性强于Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
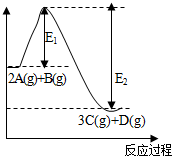 反应2A(g)+B(g)?3C(g)+D(g),△H=akJ/mol.反应过程中的能量变化如图所示.回答下列问题:
反应2A(g)+B(g)?3C(g)+D(g),△H=akJ/mol.反应过程中的能量变化如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地球上的绝大多数金属元素是以化合态形式存在 | |
| B. | 铜盐溶液都有毒,这主要是由于铜离子能使蛋白质变性 | |
| C. | 普通玻璃以纯碱、石灰石、石英砂为主要原料制得 | |
| D. | SO2气体通入氯水中可以增强氯水溶液的漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com