
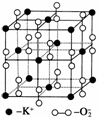
高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。右图为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
A.超氧化钾的化学式为KO2,每个晶胞中含有4个K+和4个O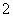
B.晶体中每个K+周围有8个O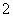 ,每个O
,每个O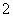 周围有8个K+
周围有8个K+
C.晶体中与每个K+距离最近且相等的K+有8个
D.晶体中0价氧与-2价氧的数目之比为5∶1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
干冰晶体是一种面心立方结构,如图所示,即8个CO2分子构成立方体的8个顶点,6个面的中心又各有1个CO2分子,在每个CO2分子周围与它的距离为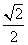 a(其中a为立方体棱长)的CO2分子有( )
a(其中a为立方体棱长)的CO2分子有( )
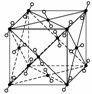
A.4个 B.8个
C.12个 D.6个
查看答案和解析>>
科目:高中化学 来源: 题型:
下面的图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的是( )

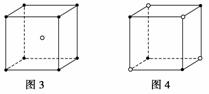
A.图1和图3 B.图2和图3
C.图1和图4 D.只有图1
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B为两种短周期元素,A的原子序数大于B,且B原子的最外层电子数为A原
子最外层电子数的3倍。A、B形成的化合物是中学化学常见的化合物,该化合物熔融
时能导电。试回答下列问题:
(1)A、B的元素符号分别是________、________。
(2)用电子式表示A、B元素形成化合物的过程:_____________________________
________________________________________________________________________。
(3)A、B所形成的化合物的晶体结构与氯化钠晶体结构相似,则每个阳离子周围吸引了
________个阴离子;晶体中阴、阳离子数之比为__________。
(4)A、B所形成化合物的晶体的熔点比NaF晶体的熔点________,其判断的理由是
________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一种金属晶体与一种离子晶体相比较,正确的是( )
A.金属晶体一定比离子晶体微粒堆积得更密集
B.金属晶体一定比离子晶体硬度大
C.金属晶体固态时一定能导电,但离子晶体不能
D.金属晶体一定比离子晶体熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物,按其晶体的熔点由高到低排列正确的是( )
A.SiC NaCl CCl4 CF4
B.SiC NaCl CF4 CCl4
C.NaCl SiC CCl4 CF4
D.CF4 CCl4 NaCl SiC
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对于金属导电性随温度变化的解释,正确的是( )
A.温度增加,自由电子的动能增大,导致金属导电性增强
B.温度增加,阳离子的动能变大,阻碍电子的运动,导致金属导电性减弱
C.温度增加,自由电子的互相碰撞的次数增加,导致金属导电性减弱
D.温度增加,阳离子的动能变大,自由电子与阳离子的吸引力变小,导致金属导电性增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com