
分析 设反应之前甲烷的物质的量为1mol,消耗的甲烷为0.2mol,根据碳原子守恒,反应后混合气体总物质的量为(1-0.2)mol+$\frac{0.2mol}{2}$=0.9mol,设得到C2H2为xmol,根据碳原子守恒,可知成C2H4为(0.1-x)mol,再根据混合气体的密度=$\frac{混合气体总质量}{混合气体总体积}$列方程计算解答.
解答 解:设反应之前甲烷的物质的量为1mol,则消耗的甲烷为1mol×20%=0.2mol,剩余甲烷为1mol-0.2mol0.8mol,
根据碳原子守恒,反应后混合气体总物质的量为(1-0.2)mol+$\frac{0.2mol}{2}$=0.9mol,则反应后混合气体总体积为0.9mol×22.4L/mol,
设得到C2H2为xmol,根据碳原子守恒,可知成C2H4为(0.1-x)mol,则:$\frac{0.8×16+26x+28×(0.1-x)}{0.9×22.4}$=0.7698,
解得x=0.0404
则混合气体中乙炔的体积分数为$\frac{0.0404mol}{0.9mol}$×100%=4.50%,
答:混合气体中乙炔的体积分数为4.50%.
点评 本题考查混合物计算,涉及物质的量有关计算,关键是碳原子守恒应用,侧重考查学生分析计算的能力,题目计算量较大,属于易错题目.


科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 molCH3COOH:CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 向HCOOK和KOH的混合溶液中加入KMnO42KMnO4+HCOOK+KOH═2K2MnO4+CO2↑+H2O | |
| C. | 4 mol/L的NaAlO2溶液和7 mol/L的盐酸等体积均匀混合:4AlO2-+7H++H2O═3Al(OH)3+Al3+ | |
| D. | 在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
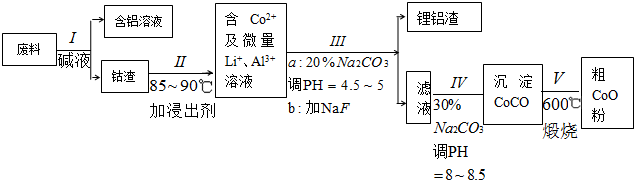
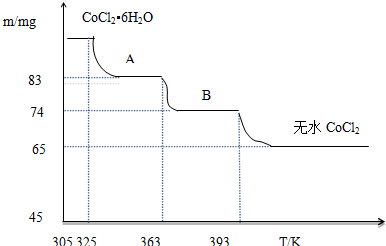
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
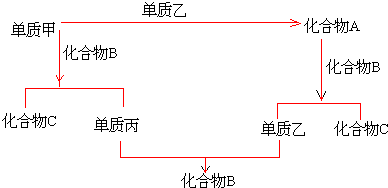
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和10mL0.1mol•L-1HAc与中和100mL0.01mol•L-1HAc所需NaOH的物质的量不同 | |
| B. | 10mL0.1mol•L-1氨水与100mL0.01mol•L-1氨水,其OH-物质的量相同 | |
| C. | 相同条件下,将pH值相同的盐酸和醋酸稀释相同的倍数,盐酸pH值变化较大 | |
| D. | 锌分别与pH=3的盐酸和pH=3的醋酸溶液反应,起始反应速率盐酸较快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | ||
| D | E | F | G |
| A. | G的最高价氧化物对应的水化物是最强的酸 | |
| B. | 熔融电解化合物D2C3可制取单质D | |
| C. | F的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | A、G分别与氢元素形成的化合物中,化学键均为极性共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com