
| A. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 某温度下,KSP(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12;将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液,则先产生Ag2CrO4沉淀 | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在0.1 mol•L-1氨水中滴加0.1 mol•L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10-amol•L-1 |
分析 A、因混合后溶液中含等量的NaCl、HAc,醋酸部分电离,溶液呈酸性,所以离子浓度大小为c(Na+)=c(Cl-)=>0.05mol•L-1>c(CH3COO-)>c(OH-);
B、根据Ksp(AgCl)、Ksp(Ag2CrO4),则当Cl-、CrO42-开始沉淀时c(Ag+)各是多少;
C、0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合中,钠与碳的所有微粒的物质的量之比为3:2,则根据物料守恒:2c(Na+)=3c(H2CO3)+3c(HCO3-)+3c(CO32-);
D、刚好完全中和时,氢离子与氢氧根离子浓度相等,pH=a的溶液中c(H+)=c(OH-)=10-amol•L-1.
解答 解:A、因混合后溶液中含等量的NaCl、HAc,醋酸部分电离,溶液呈酸性,所以离子浓度大小为c(Na+)=c(Cl-)=>0.05mol•L-1>c(CH3COO-)>c(OH-),故A正确;
B、根据Ksp(AgCl)、Ksp(Ag2CrO4),则当Cl-开始沉淀时c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=1.8×10-7mol/L,当CrO42-开始沉淀时c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{O}_{4}^{2-})}}$=4.36×10-5 mol/L,故先产生AgCl沉淀,故B错误;
C、0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合中,钠与碳的所有微粒的物质的量之比为3:2,则根据物料守恒:2c(Na+)=3c(H2CO3)+3c(HCO3-)+3c(CO32-),故C正确;
D、在0.1mol•L-1氨水中滴加0.1mol•L-1盐酸,刚好完全中和时pH=a,则溶液中c(OH-)=c(H+)=10-amol•L-1,故D正确;
故选B.
点评 本题考查了离子浓度大小比较、难溶电解质的沉淀平衡等知识,题目难度中等,判断离子是否完全,沉淀等问题,学会利用电荷守恒、物料守恒比较溶液中离子浓度大小,综合性强,难度较大.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
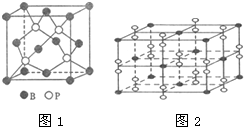 As、N、0等非金属元素的化合物在工业生产中有重要的应用.
As、N、0等非金属元素的化合物在工业生产中有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大.A的一种单质是自然界硬度最大的物质,B是地壳中含量最多的元素,C的单质能从B的一种氢化物中置换出B的一种单质,D是人体骨骼中的常见元素,D的氢氧化物常用来检验A和B形成的一种化合物,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素.
已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大.A的一种单质是自然界硬度最大的物质,B是地壳中含量最多的元素,C的单质能从B的一种氢化物中置换出B的一种单质,D是人体骨骼中的常见元素,D的氢氧化物常用来检验A和B形成的一种化合物,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素.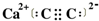 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 地沟油经过处理,可用来制造肥皂 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 丙烷(C3H8)和乙醇(C2H5OH)均存在同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在船外壳镶嵌锌块保护船身,锌为原电池的负极 | |
| B. | MgO的熔点高于NaCl,是因为MgO的晶格能大于NaCl | |
| C. | 1molFeCl3完全水解将产生6.02×1023个胶体粒子 | |
| D. | 水的离子积常数Ksp随着温度的升高而增大,说明水的电离是吸热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 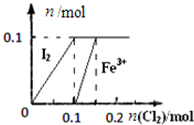 表示向100mL1 mol•L-1 FeI2溶液中逐渐通入Cl2,I2和Fe3+物质的量变化关系 | |
| B. | 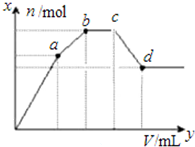 表示向100mL 0.1 mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol•L-1 Ba(OH)2溶液,沉淀物质的量变化的关系 | |
| C. |  表示在不同温度下,水溶液中c(H+)与c(OH-)变化关系 | |
| D. |  得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| K | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等体积、等物质的量浓度的CH3COOH溶液和Na2CO3溶液反应后的溶液呈碱性 | |
| B. | a mol/LHCN溶液与bmol/LNaOH溶液等体积混合,所得溶液c(Na+)>c(CN- ),则a可能等于b | |
| C. | 相同温度时,等物质的量浓度三种溶液的PH关系:NaCN>Na2CO3>CH3COONa | |
| D. | 向NaCN溶液中通入少量的CO2离子方程式为:CN-+H2O+CO2=HCN+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知X在一定条件下转化为Y,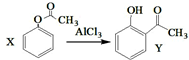 ,X与Y互为同系物,可用FeBr3溶液鉴别 ,X与Y互为同系物,可用FeBr3溶液鉴别 | |
| B. | 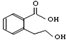 能发生的反应类型有:加成反应、取代反应、消去反应、氧化反应 能发生的反应类型有:加成反应、取代反应、消去反应、氧化反应 | |
| C. | 3-甲基-3-乙基戊烷的一氯取代产物有5种 | |
| D. | 相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com