
【题目】一种从植物中提取的天然化合物a-damascone,可用于制作“香水”,其结构为: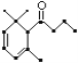 ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )
A. 分子式为C13H20O
B. 1mo该化合物可与3molH2发生加成反应
C. 1mol该化合物完全燃烧消耗18 mol O2
D. 1mol该化合物最多与2mol溴单质加成
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。

(1)甲中含氧官能团是__________(填名称)。
(2)下列关于乙的说法正确的是________(填序号)。
a.分子中碳原子与氮原子的个数比是7∶5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为________。
a.含有![]()
b.在稀硫酸中水解有乙酸生成
(4)写出丁在氢氧化钠溶液中水解的化学方程式。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 VSEPR 模型预测下列分子或离子的立体结构,其中正确的是
A. NH4+为正四面体形B. SO2 为直线形
C. HCN 为平面三角形D. BF3 为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物在冬季来临过程中,随着气温的逐渐降低,体内发生了一系列适应低温的生理生化变化,抗寒力逐渐增强。下图为冬小麦在不同时期含水量和呼吸速率变化关系图。请根据图推断以下有关说法中,错误的是( )
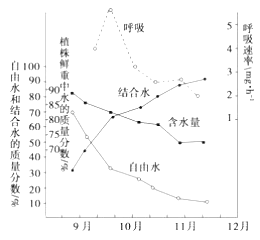
A. 冬季来临过程中,自由水明显减少是呼吸速率下降的主要原因
B. 结合水与自由水含量的比值,与植物的抗寒性呈现明显的正相关
C. 随着气温和土壤温度的下降,根系的吸水量减少,组织的含水量下降
D. 随温度的缓慢降低,植物的呼吸作用逐渐减弱,有利于减少有机物的消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种天然药物桥环分子合成的部分路线图(反应条件已经略去):
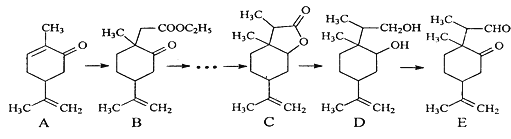
已知:①LiBH4可将醛、酮、酯类还原成醇,但不能还原羧酸、羧酸盐、碳碳双键;LiBH4遇酸易分解。
②RCH2COOR' ![]() RCH(CH3)COOR',RCOR'
RCH(CH3)COOR',RCOR' ![]() RCH(OH)R',RCOOR'
RCH(OH)R',RCOOR' ![]() RCH2OH+R'OH。
RCH2OH+R'OH。
(1)反应A→B中需要加入试剂X,其分子式为C4H8O2,X的结构简式为_____。
(2)C用LiBH4还原得到D,C→D不直接用镍作催化剂H2还原的原因是______。
(3)写出一种满足下列条件的A的同分异构体的结构简式为_____________。①属于芳香族化合物;②能使FeCl3溶液显色;③分子中有4种不同化学环境的氢。
(4)写出E和银氨溶液反应的化学方程式_________。
(5)根据已有知识并结合相关信息,设计B→C的合成路线图(CH3I和无机试剂任选),合成路线常用的表示方式为:![]() 。____________
。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)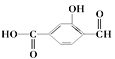 具有官能团分别为:羧基、_______和________(填名称),
具有官能团分别为:羧基、_______和________(填名称),
(2)苯酚与溴水生成白色沉淀,发生__________反应;乙烯通入溴水,发生_______反应。(填“加成”或者“取代”)
(3)以下几组:①白磷和红磷 ②D和T
③异丁烷 和2,2—二甲基丁烷 ④ CH2 = CH-CH3和![]()
其中互为同系物的是____________;互为同分异构体的是_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]铬元素在地壳中含量占第21位,是一种重要的金属。回答下列问题:
(1)基态铬原子的价电子排布式为_________________,根据价层电子判断铬元素中最高价态为___________价。铬元素的第二电离能________锰元素的第二电离能(填“>”“<”填“=”)。
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为____________________________________________(用化学方程式表示)。
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为___________晶体。二价铬还能与乙酸根形成配合物,在乙酸根中碳原子的杂化形式为___________
(3)已知CrO5中铬元素为最高价态,画出其结构式:______________________
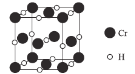
(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为___________。已知:该晶胞的边长为437.6 pm,NA表示阿伏加德罗常数的值,则晶体的密度为____g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述正确的是( )
A.H2Y的电离方程式为:![]()
B.在该酸式盐溶液中![]()
C.HY-的水解方程式为![]()
D.在该酸式盐溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Al、Si、Cu、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素同期表的_____区。
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是______(填标号)。
A. [Ne]![]() B.[Ne]
B.[Ne]![]()
![]() C.[Ne]
C.[Ne] ![]()
![]() D. [Ne]
D. [Ne]![]()
![]()
![]()
3s 3s 3p 3s 3p 3s 3p 3p
(3)从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因是_____________。
(4)一些化合物的熔点如下表所示:
化合物 | NaCl | KCl | SiO2 |
熔点/°C | 801 | 770 | 1723 |
解释表中化合物之间熔点差异的原因________________________________。
(5)NiSO4溶于氨水形成[Ni(NH3)6]SO4。
①N、O、S三种元素中电负性最大的是_______。
②写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
③1mol[Ni(NH3)6]SO4中含有δ键的数目为___________。
④NH3的VSEPR模型为____;NH3、SO42-的中心原子的杂化类型分别为___、___。
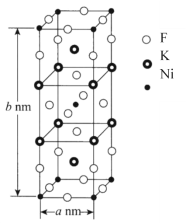
(6)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g·cm-3(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com