
【题目】工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
探究一
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用_______选填序号)
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c..浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为____________。
探究二
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含少量的H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
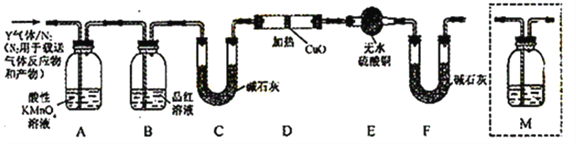
(3)装置B中试剂的作用是___________。
(4)认为气体Y中还含有Q的理由是___________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于____________(选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是___________。
【答案】 其原因是铁钉表面被钝化(或其它合理答案)。 应选用 d 选填序号)。 SO2的体积分数为66.7%(或其它合理答案)。 装置B中试剂的作用是检验SO2是否除尽。 理由是C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。 添加M于 c (选填序号)。 预计实验现象应是D中固体由黑变红和E中固体由白变蓝。
CO2↑+2SO2↑+2H2O。 添加M于 c (选填序号)。 预计实验现象应是D中固体由黑变红和E中固体由白变蓝。
【解析】试题分析:(1)铁钉放入冷硫酸中,浓硫酸有较强的氧化性能使铁钉钝化阻止反应进一步进行。
(2)①亚铁离子能使酸性高锰酸钾褪色,溶液中已经有三价铁离子,选择a会造成干扰;b能检验三价铁离子的存在;选c生成两种沉淀,受氢氧化铁沉淀颜色的影响无法分辨;Fe2+与酸性KMnO4溶液发生氧化还原反应,Fe2+能使酸性KMnO4溶液褪色,故选d; SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,生成的硫酸遇到氯化钡会产生白色沉淀,则n(混合气体)=0.336L÷22.4L/mol=0.015mol,根据对应关系:SO2~ BaSO4,
n(SO2)=n(BaSO4)=2.33g÷233g/mol,解得n(SO2)=0.01mol,所以二氧化硫的体积分数为:0.01mol÷0.015mol×100%=66.7%。
(3)A除去二氧化硫,二氧化硫能使品红溶液褪色,所以B可以检验A中是否完全除去二氧化硫。
(4)在加热时,铁钉中不仅铁和浓硫酸反应,碳也和浓硫酸反应生成生成二氧化硫、二氧化碳和水,反应方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(5)Q为二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,选择a或b受二氧化硫的影响无法判断二氧化碳的存在,选d时二氧化碳被碱石灰吸收,B-C间加入澄清石灰水可检验CO2,故选c。
(6)氢气还原氧化铜会生成水蒸气能使白色的硫酸铜粉末变蓝色,同时有红色的铜单质生成,故答案为:D中固体由黑色变红和E中固体由白变蓝。


科目:高中化学 来源: 题型:
【题目】提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为
A. 加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B. 加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C. 加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D. 加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示): ;
(2)混合溶液中由水电离出的c(H+) (填 “<”“>”或“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH (填“<”“>”或“=”)7;
(4)将相同温度下相同浓度的五种溶液:①(NH4)2CO3 ②NH3·H2O ③(NH4)2SO4 ④NH4Cl ⑤CH3COONH4;按c(NH4+)由大到小的顺序排列 (填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50g密度ρ=0.98g/mL的10%的氨水和100g密度ρ=0.93g/mL的40%的氨水混合,得到ρ=0.95g/mL氨水溶液,求所得氨水的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关工业生产的叙述不正确的是( )
A. 用海水淡化后的浓缩海水作原料提取溴
B. 在太阳能资源相对充足的沿海地区建造海水淡化厂
C. 利用“海水→氯化钠→金属钠→氢氧化钠”的工艺流程生产烧碱
D. 利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016北京】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
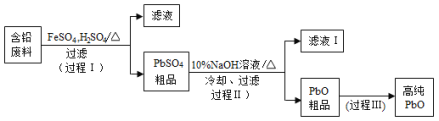
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42=2Fe3++PbSO4+2H2O
ii: ……
① 写出ii的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关麦芽糖的下列叙述中,错误的是
A. 麦芽糖易溶于水,有甜味
B. 麦芽糖不能发生银镜反应
C. 1 mol麦芽糖水解得到1 mol葡萄糖和1 mol果糖
D. 麦芽糖和蔗糖互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列性质的选项,填入各小题后面对应的括号中:
A.脱水性 B.强酸性 C.强氧化性 D.吸水性
(1)将胆矾放入装有浓H2SO4的干燥器中,过一段时间后胆矾变成白色。 (____)
(2)在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。(_____)
(3)在稀HNO3中放入铝片产生NO。(_____)
(4)在稀H2SO4中放入铝片产生H2 。(_____)
(5)在冷浓HNO3中放入铝片没有明显现象。(_____)
(6)浓H2SO4敞口久置会增重。(____)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为
A. C14H10O5 B. C14H16O4 C. C14H22O5 D. C14H18O5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com