
| A. | 1:2 | B. | 1:3 | C. | 3:4 | D. | 1:4 |
分析 根据生成的氨气的体积求出NH4+的物质的量;
根据加入足量BaCl2溶液,生成的白色沉淀的质量求出含有的SO42-的物质的量,但由于溶液中的硫酸根还来自于 H2SO4溶液,故据此求出黄铵铁矾提供的SO42-的物质的量;
黄铵铁钒中铁为+3价.另取出25mL稀释后的溶液,先将Fe3+还原为Fe2+,然后加入0.2000mol/LK2Cr2O7标准溶液滴定至终点,消耗标准溶液25.00ml,
由根据反应消耗K2Cr2O7标准溶液的物质的量求出溶液中n(Fe2+),而n(Fe2+)=n(Fe3+).
即可气促胡25mL的溶液中n(NH4+):n(Fe3+):n(SO42-),然后根据化合物的化合价的代数和为0可解得m,据此分析.
解答 解:在25mL溶液中含有的NH4+的物质的量为n(NH4+)=$\frac{0.224L}{22.4L/mol}$=0.01mol;
加入足量BaCl2溶液,生成的白色沉淀6.99g,故溶液中含有的SO42-的物质的量为n(SO42-)=$\frac{6.99g}{233g/mol}$=0.03mol,而由于溶液中的硫酸根还来自于 H2SO4溶液,且来自于硫酸溶液的SO42-的物质的量为n(SO42-)=$\frac{2mol/L×0.05L}{10}$=0.01mol,故黄铵铁矾提供的SO42-的物质的量为0.02mol;
黄铵铁钒中铁为+3价.另取出25mL稀释后的溶液,先将Fe3+还原为Fe2+,然后加入0.2000mol/LK2Cr2O7标准溶液滴定至终点,消耗标准溶液25.00ml,
由根据反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可知,由于反应消耗K2Cr2O7标准溶液的物质的量n=CV=0.2mol/L×0.025L=0.005mol,故25mL溶液中n(Fe3+)=0.005mol×6=0.03mol.
即25mL的溶液中n(NH4+):n(Fe3+):n(SO42-)=1:3:2,即x:y:n=1:3:2,根据化合物的化合价的代数和为0可知:1×1+3×3=2×2+m,解得m=6.
故n:m=2:6=1:3.
故选B.
点评 本题综合考查了化学方程式的有关计算,综合性较强,难度较大,仔细审题、注意实验数据的处理是关键.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
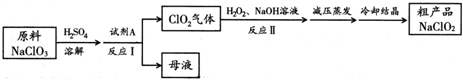
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr、HCl、HF | B. | K、Mg、Na | ||
| C. | MgO、NaCl、KBr | D. | 晶体硅、碳化硅、金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氧为32g | |
| B. | 摩尔是物质的量的单位 | |
| C. | 44gCO2的体积为22.4L | |
| D. | 2mol/L的BaCl2溶液中含Cl-的个数为2.408×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖在人体内水解产物只有葡萄糖 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 淀粉和纤维素水解最终产物都是葡萄糖 | |
| D. | 鉴别部分蛋白质可利用浓硫酸与蛋白质的颜色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有氧化性 | B. | 具有还原性 | C. | 具有漂白性 | D. | 含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
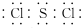 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:计算题
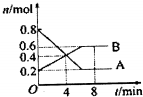 某温度时,在0.5L密闭容器中某一反应的A、B气体物质随时间变化的曲线如图所示,完成下列问题:
某温度时,在0.5L密闭容器中某一反应的A、B气体物质随时间变化的曲线如图所示,完成下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com