
【题目】化学反应的限度是当和相等,反应物和生成物的保持不变时,所达到的一种看似静止的“平衡状态”.
科目:高中化学 来源: 题型:
【题目】某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧,发生2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝锂钴废料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质)回收CoO的工艺流程如下:
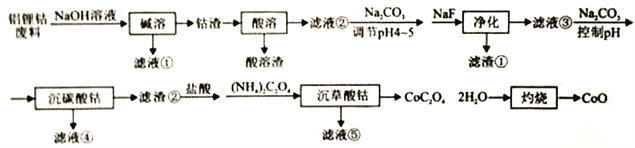
回答下列问题:
(1)“碱溶”的目的是:________________。
(2)不同浸出剂“酸溶”实验结果见下表,根据数据和物质性质应选择的浸出剂是___________(填序号),理由是__________ (用Co3O4参与反应的离子方程式表示)。
浸出剂 | 浸出液化学成分/(g·L-1) | 钴浸出率/% | |
Co | Al | ||
(a)HCI | 80.84 | 5.68 | 98.4 |
(b)H2SO4 | 65.0 | 6.22 | 72.3 |
(c)H2SO4+ Na2S2O3 | 84.91 | 5.96 | 98.0 |
(3)“净化”产生的滤渣为____________(填化学式),滤液③中c(F-)=4.0×10-3mol·L-1,则“净化”后残余c(Li+)=___________。LiF与Li2CO3的Ksp分别为1.8×10-3、1.7×10-3。
(4)若滤液④中含Co2+为5.9×10-2g·L-1,“沉碳酸钴"应控制pH不高于___________。Co(OH)2的Ksp为1.0×10-15。
(5)“沉碳酸钴“→“沉草酸钻”的目的是___________。
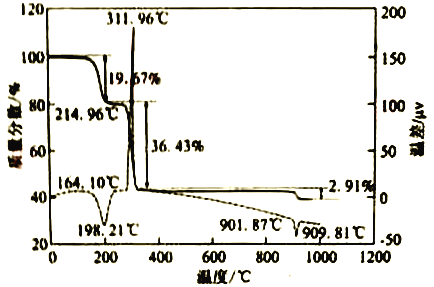
(6)CaC2O4·H2O在空气氛围中的热重曲线如下图。在311.96℃附近有个很强的放热峰的原因是______。900℃发生反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列 11 种物质:
①纯碱 ②Mn2O7 ③硫酸 ④CaO ⑤CO2 ⑥Na2CO3
⑦CuSO4·5H2O ⑧SO2 ⑨Na2O2 ⑩CO NO2
其中属于正盐的是______________;属于酸性氧化物的是__________________。
(2)有关胶体的实验中:
①实验室制备Fe(OH)3胶体的化学方程式为_________
②将橘红色的硫化锑(Sb2S3)胶体,装入U形管,插入电极后通直流电,发现阳极负极橘红色加深,证明Sb2S3胶粒带______(填“正”或“负”)电荷。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 0.100 | 0.076 | 0.060 | 0.060 | 0.050 | 0.050 |
N2 | 0 | 0.012 | 0.020 | 0.020 | 0.025 | 0.025 |
CO2 | 0 | 0.012 | 0.020 | 0.020 | 0.011 | 0.011 |
(1
(2)30s后,改变某一条件,反应重新达到平衡,则改变的条件可能是________,若30s后升高温度至T2℃,平衡时,容器中NO的浓度由0.060mol/L变为0.072mol/L,则该反应的a___0 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某混合溶液中只含有下列几种离子(不考虑水的电离):Na+、Mg2+、Al3+、Cl-、SO42-,若Na+、Mg2+、Cl-、SO42-的物质的量浓度依次为 0.2 mol/L、0.25 mol/L、0.5 mol/L、0.25mol/L,则 c(Al3+)=________ 。
(2) 某物质 A 加热时按化学方程式 2A═2B+C+3D 分解,产物均为气体,测得由生成物组成的混 合物气体对 H2 的相对密度为 20,则反应物 A 的摩尔质量为_____ 。
(3)在标准状况下,将 VL A 气体(摩尔质量为 Mg/mol)溶于 0.1L 水中,所得溶液的密度为ρg/cm3,则此溶液的物质的量浓度为_________mol·L-1
A.1000Vρ/(MV+22400)mol·L-1 B.Vρ/(MV+22400)mol·L-1
C.100VρM/(MV+22400)mol·L-1 D.MV/22.4(V+0.1) ρmol·L-1
(4)生态农业涉及农家肥料的综合利用.某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气 的混合气体 8.96L(标准状况).该气体通过盛有红色 CuO 粉末的硬质玻璃管,发生的反应为:CH4+4CuO![]() CO2↑+2H2O↑+4Cu,.当甲烷完全反应后,硬质玻璃管的质量减轻了 4.8g。将反应后气体通入 2L 0.1mol/L 的澄清 Ca(OH)2 溶液,充分吸收,生成沉淀 10g.求:
CO2↑+2H2O↑+4Cu,.当甲烷完全反应后,硬质玻璃管的质量减轻了 4.8g。将反应后气体通入 2L 0.1mol/L 的澄清 Ca(OH)2 溶液,充分吸收,生成沉淀 10g.求:
①原混合气体中甲烷的体积(标准状况)___________________________________________________
②反应后的气体中 CO2 的物质的量为_______________________
(5)为确定铬钾矾 xK2SO4·yCr2(SO4)3·zH2O的分子式,配成含此物质 31.28g 的溶 液 400mL,取 200mL 的溶液加入 1mol/L 的Ba(NO3)2溶液 100mL,生成沉淀,过滤后滤液中 加入 0.1mol/L H2SO4 溶液,消耗 200mL 硫酸时沉淀恰好完全,用过量氨水处理剩余的 200mL 溶液,生成 Cr(OH)3 沉淀 4.12g,试确定 x、y、z 的值.____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料。
(1)氯气是一种黄绿色非金属气体,化学性质上和氧气有许多相似之处,比如:氯气也能支持燃烧,写出铁丝在氯气中燃烧的方程式:______;
(2)氯气和石灰乳反应可以制得漂白粉,漂白粉暴露在空气中因吸收了空气中的CO2和H2O而失效,漂白粉失效过程的化学反应方程式为:______。
(3)氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应,填空(b、c、d、e中重合部分代表物质间反应,且氯水足量)。

①c过程的反应方程式______,e过程中的化学方程式为______。
②d过程所观察到的现象为:______,b过程证明了氯水的存在______微粒。
a.Cl2 b.Cl- c.HClO d.H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓度均为4.0 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的锌粉,充分反应后生成气体体积比为2∶3,则加入锌粉的质量是
A. 6.5 g B. 13.0 g C. 19.5 g D. 26.0 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com