
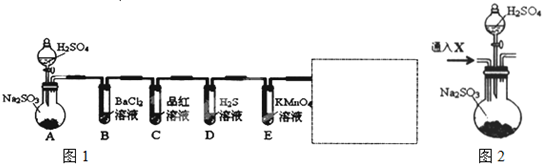
分析 装置A:制备二氧化硫,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,装置B:探究亚硫酸与氯化钡是否反应,装置C:探究二氧化硫的漂白性,装置D:探究二氧化硫的氧化性,装置E:探究二氧化硫的还原性,方框中收集SO2以及尾气处理装置.
(1)装置D探究二氧化硫的氧化性,二氧化硫与硫化氢溶液生成了单质硫,装置A中生成的二氧化硫气体具有漂白性、还原性等,通过装置C中的品红溶液会褪色表现了二氧化硫的漂白性,二氧化硫通过装置E中的高锰酸钾溶液,还原高锰酸钾溶液褪色;
(2)由于二氧化硫的相对分子质量比空气大,故用向上排空气法收集气体,因为二氧化硫有毒,需要对尾气进行吸收处理,二氧化硫酸性气体尾气用氢氧化钠吸收;
(3)白色沉淀不溶于稀盐酸,该沉淀只能为硫酸钡;可能原因为亚硫酸被氧化成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀;连接后往装置F中通入气体X一段时间,排除装置中的氧气,通入的气体不能氧化二氧化硫,干扰验证实验;
(4)①用蒸馏水洗涤沉淀2~3次,若在洗液中加入AgNO3溶液,无沉淀出现,说明滤液中不含有Cl-;
②利用关系式:SO2~SO42-~BaSO4,根据BaSO4沉淀的质量求出SO2的体积,最后求出体积分数.
解答 解:(1)装置D探究二氧化硫的氧化性,二氧化硫具有氧化性,二氧化硫与硫化氢溶液发生反应2H2S+SO2=3S↓+2H2O,生成了单质硫,所以能观察到溶液出现淡黄色浑浊或淡黄色沉淀,装置A中生成的二氧化硫气体具有漂白性、还原性等,通过装置C中的品红溶液会褪色表现了二氧化硫的漂白性,二氧化硫通过装置E中的高锰酸钾溶液,还原高锰酸钾溶液褪色,表现了二氧化硫的还原性,
故答案为:出现淡黄色浑浊或淡黄色沉淀;漂白性,还原性;
(2)由于二氧化硫的相对分子质量比空气大,故用向上排空气法收集气体,因为二氧化硫有毒,需要对尾气进行吸收处理,可用碱液氢氧化钠吸收,装置为: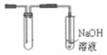 ,
,
故答案为: ;
;
(3)某学习小组向盛有氯化钡溶液的试管中通入二氧化硫气体,发现有白色沉淀,向试管中加入过量稀盐酸,沉淀不溶解,该白色沉淀为BaSO4,产生沉淀的原因可能为,
B中形成沉淀是二氧化硫被氧气氧化,可能发生的反应为:2SO2+2H2O+O2+2BaCl2=2BaSO4↓+4HCl或2SO2+2H2O+O2=2H2SO4、H2SO4+BaCl2=BaSO4↓+2HCl,
O3和NO2,具有氧化性,能氧化二氧化硫,所以不可以通入气体这两种气体驱赶装置中的氧气,NH3是碱性气体和二氧化硫发生反应生成亚硫酸铵,不能达到大量二氧化硫气体,所以选择二氧化碳或氮气排除装置中的空气,选AD,
故答案为:BaSO4;2SO2+2H2O+O2+2BaCl2=2BaSO4↓+4HCl或2SO2+2H2O+O2=2H2SO4、H2SO4+BaCl2=BaSO4↓+2HCl;AD;
(4)①沿玻璃棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2~3次.检验洗涤沉淀已经干净的实验操作:取最后一次洗涤液,溶液中加入AgNO3溶液,无沉淀出现,说明滤液中不含有Cl-,即沉淀已洗涤干净,
故答案为:取最后一次洗涤液,溶液中加入AgNO3溶液,无沉淀出现,说明滤液中不含有Cl-,即沉淀已洗涤干净;
②SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况),缓慢通过足量溴水中,在所得溶液中加入过量BaCl2溶液,将产生的白色沉淀洗涤,干燥,用电子称称其质量为0.233g,
利用关系式:SO2 ~SO42-~BaSO4,
0.001mol $\frac{0.233g}{233g/mol}$=1×10-3mol
n(SO2)=n(BaSO4)=1×10-3mol
10m3空气中SO2的体积分数为$\frac{1×1{0}^{3}mol×64g/mol×1000mg/g}{10{m}^{3}}$×100%=6.4mg/m3,
故答案为:6.4mg/m3.
点评 本题属于实验探究题,主要考查实验装置的搭配、SO2的性质及实验过程中的问题分析,要根据实验原理提出假设,再结合物质的性质加以验证,侧重于考查学生的实验探究能力和对知识的应用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氧化铁与醋酸:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 碳酸钠与盐酸:Na2CO3+2H+═2Na++CO2↑+H2O | |
| C. | 铁片插入到硫酸铜溶液中:2Fe+3Cu2+═2Fe3++3Cu | |
| D. | 向盐酸中加入适量氨水:H++NH3•H2O═NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  | 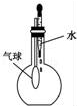 | 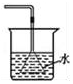 |
| A.除去CO气体中的CO2气体 | B.分离碘酒中的碘和酒精 | C.验证NH3的溶解性 | D.吸收HCl防倒吸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定存在SO42-和Cl- | |
| B. | 取③中滤液加入KSCN,溶液显红色,则原溶液一定有Fe3+ | |
| C. | 原溶液中一定不存在Ba2+和HCO3- | |
| D. | 为确定原溶液中是否含有K+,可通过焰色反应直接观察焰色是否为紫色来确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6和C5H12一定互为同系物 | |
| B. | 1mol葡萄糖与足量的金属钠反应,最多可生成2.5molH2 | |
| C. | 三氯甲烷只有一种结构证明甲烷是正四面体构型 | |
| D. | 油脂是食物中产生能量最高的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
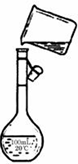 (5)为检验精盐纯度,需配制100mL 1mol/L NaCl溶液,右图是该同学转移溶液的示意图,图中的错误是未用玻璃棒引流
(5)为检验精盐纯度,需配制100mL 1mol/L NaCl溶液,右图是该同学转移溶液的示意图,图中的错误是未用玻璃棒引流查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O═H2CO3 | B. | CO+CuO═Cu+CO2 | ||
| C. | 2H2O═2H2↑+O2↑ | D. | FeS+H2SO4═FeSO4+H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com