
【题目】(1)乙炔的电子式__________________。
(2)![]() 分子式:_________________。
分子式:_________________。
(3)![]() 其苯环上的一氯代物有______种
其苯环上的一氯代物有______种
(4)结构简式为![]() 此烃名称为___________________。
此烃名称为___________________。
(5) 4,4,5﹣三甲基﹣2﹣己炔(写出结构简式) ____________。
(6)结构简式为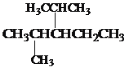 的烃可命名为:____________________。
的烃可命名为:____________________。
(7)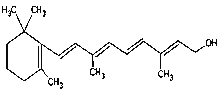 1mol该物质消耗_______molH2.
1mol该物质消耗_______molH2.
(8)鉴别苯,碘化钾溶液,硝酸银溶液,己烯,四氯化碳时,只能用一种试剂,该试剂是_________;
【答案】![]() C12H10 3 3-甲基-2-丙基-1-戊烯
C12H10 3 3-甲基-2-丙基-1-戊烯 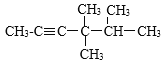 2,4-二甲基-3-乙基戊烷 5 浓溴水
2,4-二甲基-3-乙基戊烷 5 浓溴水
【解析】
(1)乙炔分子中两个C原子之间形成3个共价键,每个C原子再与一个H原子形成一个共价键;
(2)根据物质结构可知该物质分子式为C12H10;
(3)从对称角度分析苯环上H原子的种类来确定其一氯取代产物;
(4)根据烯烃的命名方法命名;
(5)根据炔烃的命名方法,由名称书写其相应的结构简式;
(6)根据烷烃的命名方法命名;
(7)碳碳双键可以与氢气发生加成反应,一个碳碳双键发生加成反应需消耗1个氢气;
(8)苯不溶于水,密度比水小,可以萃取溴水中的溴,溶液分层,有机层在上方;苯酚与浓溴水反应生成白色沉淀;碘化钾与溴水发生氧化还原反应生成单质碘;硝酸银与溴水反应生成浅黄色沉淀;己烯与溴发生加成反应,溴水颜色褪去;四氯化碳不溶于水,但密度比水大,可以萃取溴水中的溴,溶液分层,有机层在下层,可用浓溴水鉴别有机物。
(1)乙炔分子中两个C原子形成3个共价键,每个C原子再与一个H原子形成一个共价键,因此乙炔的电子式为:![]() ;
;
(2)根据物质结构可知该物质分子式为C12H10;
(3)乙苯![]() 苯环上有邻、间、对三种不同位置的H原子,因此其苯环上的一氯取代产物有3种;
苯环上有邻、间、对三种不同位置的H原子,因此其苯环上的一氯取代产物有3种;
(4)选择含有碳碳双键在内的最长的碳链为主链,从离碳碳双键较近的一端给主链上的C原子编号,以确定碳碳双键和支链的位置,该物质名称为3-甲基-2-丙基-1-戊烯;
(5)选择含有碳碳三键在内的最长的碳链为主链,从离碳碳三键较近的一端给主链上的C原子编号,以确定碳碳三键和支链的位置,该物质名称为4,4,5﹣三甲基﹣2﹣己炔,则其相应的结构简式为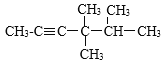 ;
;
(6)选择分子中最长的碳链为主链,当有多个最长碳链时,尽可能使支链简单,从离支链较近的一端为起点,给主链上碳原子编号,来确定支链的位置,该物质名称为2,4-二甲基-3-乙基戊烷;
(7)碳碳双键可以与氢气发生加成反应,一个碳碳双键发生加成反应需消耗1个氢气分子,由于在该物质分子中含有5个碳碳双键,因此1mol该化合物完全与氢气加成,需消耗氢气的物质的量为5mol;
(8)苯不溶于水,密度比水小,可以萃取溴水中的溴,溶液分层,有机层在上方;苯酚与浓溴水反应生成白色沉淀;碘化钾与溴水发生氧化还原反应生成单质碘,使溶液呈棕黄色;硝酸银与溴水反应生成浅黄色AgBr沉淀;己烯与溴发生加成反应使溴水颜色褪去;四氯化碳不溶于水,但密度比水大,可以萃取溴水中的溴,溶液分层,有机层在下层,因此可用浓溴水鉴别有机物,即鉴别上述物质物质的化学试剂是浓溴水。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的价电子排布式为nsnnpn |
Y | Y的负一价离子的电子层结构都与氩相同 |
Z | 常温常压下,Z单质是淡黄色固体,常在火山口附近沉积 |
W | W原子共有6个价电子,其中五个价电子位于第三能层d轨道 |
(1)Z在元素周期表中的位置 _______________________,Z的氢化物空间构型是________
(2)在H—Y、H—Z两种共价键中,键的极性较强的是____________(用相应的元素符号表示该共价键)。
(3)XZ2分子中X以________方式杂化。
(4)写出W元素的原子核外电子排布式___________________________________。
(5)Y元素和Na形成晶体的部分结构可用下图中的_________来表示(填序号)。
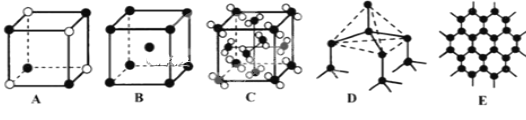
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是

A. 曲线①代表滴定CH3COOH溶液的曲线
B. A、C两点对应溶液均呈中性
C. B点溶液中:c(Na+) > c(OH-) > c(CH3COO-)
D. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是合成太阳能敏化剂的原料。一定温度下,在三个体积均为2.0 L的恒容密闭容器中按不同方式投入反应物,发生反应CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g),测得有关实验数据如下:
容器编号 | 温度/K | 起始物质的量(mol) | 平衡物质的量mol | ||||
CH3OH | NH3 | CH3NH2 | H2O | CH3NH2 | H2O | ||
I | 530 | 0.40 | 0.40 | 0 | 0 | 0.30 | |
II | 530 | 0.80 | 0.80 | 0 | 0 | ||
III | 500 | 0 | 0 | 0.20 | 0.20 | 0.16 | |
下列说法正确的是( )
A. 正反应的平衡常数K(Ⅰ)=K(Ⅱ)<K(Ⅲ)
B. 达到平衡时,体系中c(CH3OH)关系:2c(CH3OH,Ⅰ)>c(CH3OH,Ⅱ)
D. 530K时,若起始向容器Ⅰ中充入CH3OH 0.10 mol、NH3 0.15 mol、CH3NH2 0.10 mol、H2O 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g)![]() N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
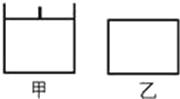
A.该反应的平衡常数表达式K=![]()
B.达到平衡所需时间,甲与乙相等
C.平衡时NO2体积分数:甲<乙
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥法标出电子转移的方向和数目
①Cl2+SO2 +2H2O=H2SO4 +2HCl ____________________
②2Na2O2+2H2O=4NaOH+O2↑____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,对可逆反应2SO2(g)+O2(g)![]() 2SO3(g),下列叙述中,能说明反应已达到化学平衡状态的是( )
2SO3(g),下列叙述中,能说明反应已达到化学平衡状态的是( )
①单位时间内断裂a mol O=O键,同时生成2a mol SO3②SO2生成的速率与SO3分解的速率相等③容器内的压强不再变化④混合气体的物质的量不再变化⑤混合气体的平均相对分子质量不再变化⑥混合气体的密度不再变化
A. ②③④B. ②④⑥C. ③④⑤D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11` | 3.0×10-8 |
请回答下列问题:
(1)写出碳酸的第一级电离方程式:________。
(2)物质的量浓度相同的三种溶液:a.CH3COONa b.NaHCO3 c.NaClO
三种溶液的pH由小到大排列的顺序是___<___< ___(用编号填写)
(3)写出向NaClO溶液中通入少量CO2的化学方程式________。
Ⅱ.(4)碳酸钠溶液呈碱性的原因是:______。(写出离子方程式)。0.01mol/L Na2CO3溶液的pH____0.1mol/LNa2CO3溶液的pH。(填“>”或“<”或“==”)
(5)浓度均为0.1mol/L的①CH3COONa溶液②NH4Cl溶液③稀HCl④Na2SO4溶液按pH由大到小的排列顺序为____
(6)打开无水FeCl3的试剂瓶,常冒出许多“白烟”,发生反应的化学方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、X、Y、Z原子序数依次增大,A元素所处的周期数、主族序数、原子序数均相等,B的气态氢化物是天然气的主要成分,Y的最外层电子数是其内层电子数的3倍 ,Z单质可制成半导体材料,B、Z同主族。
①写出Z的原子结构示意图_______________________。
②元素Y在周期表中的位置________________________。
③A与X可形成电子总数为10的微粒,其中形成的分子的结构式为_______________,形成的离子的化学式为_________________。
④较化合物BY2与ZY2的熔点高低:___________>___________(填化学式),因为ZY2属于________晶体(填晶体类型),熔化时需破坏___________(填“共价键”、“离子键”或“分子间作用力”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com