
| A. | 使用催化剂不能改变反应速率 | B. | 降低压强能使反应速率加快 | ||
| C. | 改变压强对反应速率没有影响 | D. | 升高温度能加快反应速率 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
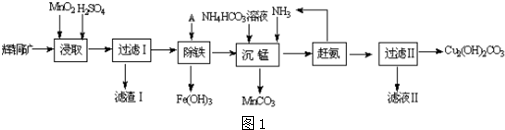
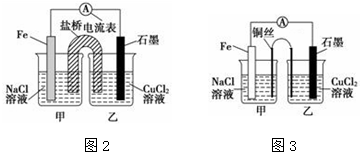
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、C2H2、N2 | |
| B. | SO2、NO${\;}_{2}^{+}$、N${\;}_{3}^{-}$、CNO- | |
| C. | CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、BeCl2 | |
| D. | SiF4、SiO${\;}_{4}^{4-}$、SO${\;}_{4}^{2-}$、PO${\;}_{4}^{3-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
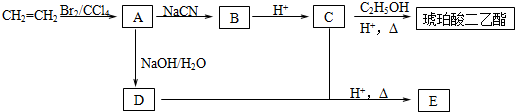
 +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ①②③④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B的原子序数之差为8 | B. | A和B原子最外层电子数之和为8 | ||
| C. | A和B原子最外层电子数之和为3 | D. | A、B原子核外电子数总和可能为11 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子” | |
| B. | 核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子” | |
| C. | 核外电子数为偶数的基态原子,其原子轨道中一定含有“电子对” | |
| D. | 核外电子数为奇数的基态原子,其原子轨道中可能含有“电子对” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com