
【题目】下列分子或离子的中心原子杂化轨道的类型相同的是( )
A.SO32-与SO3B.CH4与H2OC.NCl3与BF3D.SO32-与CO32-
【答案】B
【解析】
根据题中分子或离子的中心原子杂化轨道的类型可知,本题考查原子的杂化类型,根据VSEPR理论分析。
A.![]() 中S原子价层电子对个数
中S原子价层电子对个数![]() 、
、![]() 中S原子价层电子对个数
中S原子价层电子对个数![]() ,所以
,所以![]() 与
与![]() 中S原子杂化类型分别是
中S原子杂化类型分别是![]() 、
、![]() ,杂化类型不同,故A错误;
,杂化类型不同,故A错误;
B.![]() 中C原子价层电子对个数
中C原子价层电子对个数![]() 、
、![]() 中O原子价层电子对个数
中O原子价层电子对个数![]() ,所以两种分子中价层电子对个数相等,C、O原子杂化类型都是
,所以两种分子中价层电子对个数相等,C、O原子杂化类型都是![]() ,杂化类型相同,故B正确;
,杂化类型相同,故B正确;
C.![]() 中N原子价层电子对个数
中N原子价层电子对个数![]() 、
、![]() 中B原子价层电子对个数
中B原子价层电子对个数![]() ,
,![]() 中N原子杂化方式为
中N原子杂化方式为![]() 、
、![]() 中B原子杂化方式为
中B原子杂化方式为![]() ,杂化类型不同,故C错误;
,杂化类型不同,故C错误;
D.![]() 中S原子价层电子对个数
中S原子价层电子对个数![]() ,则S原子杂化类型是
,则S原子杂化类型是![]() ,
,![]() 中C原子价层电子对个数
中C原子价层电子对个数![]() ,C原子杂化方式为
,C原子杂化方式为![]() ,杂化类型不同,故D错误;
,杂化类型不同,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,放电时的反应为:LixC6+Li1-xFePO4=6C+LiFePO4 。某磷酸铁锂电池的切面如下图所示。下列说法错误的是

A.放电时Li+脱离石墨,经电解质嵌入正极
B.隔膜在反应过程中只允许Li+ 通过
C.充电时电池正极上发生的反应为:LiFePO4-xe-= Li1-xFePO4+xLi+
D.充电时电子从电源经铝箔流入正极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,相关示意图像错误的是:
A.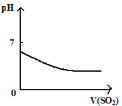 将二氧化硫通入到一定量氯水中
将二氧化硫通入到一定量氯水中
B.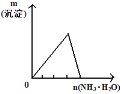 将氨水滴入到一定量氯化铝溶液中
将氨水滴入到一定量氯化铝溶液中
C.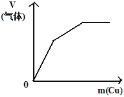 将铜粉加入到一定量浓硝酸中
将铜粉加入到一定量浓硝酸中
D.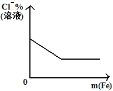 将铁粉加入到一定量氯化铁溶液中
将铁粉加入到一定量氯化铁溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于金属锌本身的价值不高,在我国工业锌废料的回收利用率比较低。某课题组研究利用含少量铜、铁的粗锌制备硫酸锌及相关物质的资源综合利用,其工艺流程图(图中加入的物质均为足量)及有关数据如下:

物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
Ksp | 4.0×10—38 | 5.0×10—20 | 2.0×10—16 | 8.5×10—45 | 1.2×10—23 |
请回答下列问题:
(1)固体A的主要成分是_______________;加入固体B的主要作用是____________。
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为_____________________________。
(3)若溶液II中c(Cu2+)为0.05mol·L—1,则溶液II的pH≤_________。
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol·L—1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是___________;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为________________________。
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的___________杂质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
写出CO与H2反应生成CH4和H2O的热化学方程式____________
已知: CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g)![]() C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中
通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式____________。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_________P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)___________v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K=__________。(计算结果保留两位有效数字)
2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_________P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)___________v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K=__________。(计算结果保留两位有效数字)

(4)以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是________________。
②为了提高该反应中CH4的转化率,可以采取的措施是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了__的作用力;二氧化硅熔化,粒子间克服了__的作用力;碘的升华,粒子间克服了__的作用力.三种晶体的熔点由高到低的顺序是__.
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__(填序号).
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有__,由非极性键形成的非极性分子有__,能形成分子晶体的物质是__,含有氢键的晶体的化学式是__,属于离子晶体的是__,属于原子晶体的是__,五种物质的熔点由高到低的顺序是__.
(4)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__.
(5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.__;B.__;C.__;D.__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电、请完成以下与甲醇有关的问题:
(1)工业上有一种生产甲醇的反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);ΔH=-49kJ·mol-1。在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
CH3OH(g)+H2O(g);ΔH=-49kJ·mol-1。在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:

①从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为___。
②A中达到平衡时CO2的转化率为___。
③a=___。
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图:

①写出甲中通入甲醇这一极的电极反应式___。
②理论上乙中两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式___;在t2时所得溶液的pH约为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B.H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C.HCO3- 在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
D.CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com