
H2O2分别在无催化剂、催化剂M和N作用下分解,其能量随反应进程的变化如下图所示。有关2H2O2(l)= 2H2O(l)+O2(g) ΔH 的下列说法正确的是
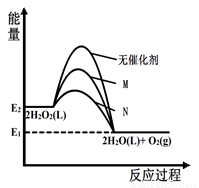
A.ΔH= E2-E1
B.实验中,M催化效率低于N
C.加入催化剂M、N,降低了反应的ΔH
D.在无催化剂时,该反应历程活化能最低
科目:高中化学 来源:2017届山东省高三上学期10月月考化学试卷(解析版) 题型:实验题
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,Al2O3:约10%,MgO:约5%.目前我国已经在技术上取得突破--用硫酸渣炼铁.Fe3+开始沉淀为氢氧化物的PH=1,沉淀完全时的PH为3.7.
I.某探究性学习小组的同学设计了不同的方案,用化学基本知识进行金属元素的提取实验。
方案一:
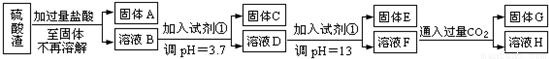
请回答:
(1)写出固体E的化学式:______________.试剂①是__________(填选项字母).
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(2)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是__________(填选项字母).
A.石蕊试液 B.广泛pH试纸 C.pH计
(3)溶液H中溶质的化学式:______________
(4)要将 固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操作为________________.
固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操作为________________.
方案二:
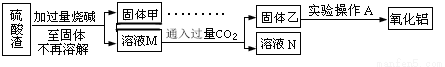
(5) 此方案制得的氧化铝含有的主要杂质是_________________。
此方案制得的氧化铝含有的主要杂质是_________________。
(6)写出由溶液M→固体乙这个过程中,主要化学反应的离子方程式:_______________;_______________。
(7)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:_______________。
(8)某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液10.00mL,则残留物中铁元素的质量分数是_____________.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省宁德市高二上期中化学试卷(解析版) 题型:选择题
为了更好的解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻我新能源。以下做法不能提高燃料效率的是( )
A.煤的汽化与液化 B.液体燃料呈雾状喷出
C.通人大大过量的空气 D.将煤粉碎后燃烧
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省海宁市三校高二下学期期中化学试卷(解析版) 题型:选择题
下列关于金属的腐蚀及防腐说法错误的是
A.马口铁(镀锡铁)镀层破损铁的腐蚀速率加快
B.为了防止钢铁设备腐蚀 ,利用外加电流的阴极保护法,应另附加一惰性电极
,利用外加电流的阴极保护法,应另附加一惰性电极 ,惰性电极作阴极
,惰性电极作阴极
C.可以采用改变金属组成或结构的方法防止金属腐蚀
D.为保护海轮的船壳,利用牺牲阳极的阴极保护法,常在船壳上镶入锌块
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省海宁市三校高二下学期期中化学试卷(解析版) 题型:选择题
有关X、Y、Z、W四种金属进行如下实验:
1 | 将X和Y用导线连接,浸入电解质溶液中,Y不易腐蚀 |
2 | 将片状的X、W分别投入等浓度盐酸中都有气体产生,W比X反应剧烈 |
3 | 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析 |
根据以下事实,下列判断或推测错误的是
A.Z的阳离子氧化性最强
B.W的还原性强于Y的还原性
C.Z放入CuSO4溶液中一定有Cu析出
D.用X、Z和稀硫酸可构成原电池,且X做负极
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上学期期中理化学试卷(解析版) 题型:填空题
贞丰中学化学兴趣小组甲、乙、丙、三名同学探究化学反应速率的影响因素,实验如下。
(1)甲同学探究“温度对化学反应速率的影响”。取两支试管A、B,分别加入25mL 1mol/L 的HNO3溶液和0.5g相同的铜片,将A放在常温下,将B放在60摄氏度的水浴中。观察实验现象:铜片最先完全溶解的是 (填A或B)。据此得出结论 ,温度影响反应速率的本质原因 ,
(2)乙同学取两支试管C、D,各加入4mL0.01mol/LKMnO4酸性溶液,C中加入2mL0.1mol/LH2C2O4溶液,D中加入2mL0.2mol/LH2C2O4溶液,观察到的现象是 ,据此乙同学得出“反应物浓度越大,反应速率越快”的结论。写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式 ,
(3)丙同学探究0.1mol/L FeCl3溶液对10%的H2O2溶液分解速率的影响,请你为她设计实验。
实验原理: (用化学方程式表示)。
实验操作: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上学期期中理化学试卷(解析版) 题型:选择题
下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),增大N2的浓度时,平衡一定向正反应方向移动
2NH3(g),增大N2的浓度时,平衡一定向正反应方向移动
③已达平衡的反应A(g)+B(g) C(g)+D(g),升高温度,A的反应速率增大,则平衡一定正向移动
C(g)+D(g),升高温度,A的反应速率增大,则平衡一定正向移动
④已达平衡的反应H2(g) + I2(g)  2HI(g),恒压条件下充入氦气,平衡不移动
2HI(g),恒压条件下充入氦气,平衡不移动
A.①④ B.③④ C.①③ D.②③
查看答案和解析>>
科目:高中化学 来源:2017届陕西省宝鸡市岐山县高三上期中化学试卷(解析版) 题型:推断题
某透明澄清溶液可能含有Na+、Fe3+、Ba2+、CO32-、SO32-、SO42-、Cl-、I-等离子中的几种,为鉴别这些离子,分别取三份少量溶液,按照以下顺序进行三个实验:
实验①:加CCl4,再滴加少量氯水,振荡后,CCl4后层变为紫色;
实验②:加盐酸后,生成无色无味气体,该气体能使饱和石灰水变浑浊;
实验③:加BaCl2溶液产生白色沉淀,过滤出沉淀,在沉淀中加入足量盐酸,沉淀不能完全溶解。
(1)分析上述3个实验,用离子符号写出每一个实验得出的结论,可不必完全填满。
实验①:含有 ;不含 ;
实验②:含有 ;不含 ;
实验③:含有 ;不含 ;
(2)通过上述实验,不能确定是否存在的离子是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省龙岩四校高二上学期期中联考化学试卷(解析版) 题型:选择题
COCl2(g) CO(g)+Cl2(g)△ H>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g)△ H>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.③⑤⑥ C.②③⑤ D.①④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com