
【题目】“清肺排毒汤”对新冠肺炎病毒感染具有良好的效果,其中一味中药黄芩的一种活性中间体的结构为: ,现在可人工合成,路线如图所示:
,现在可人工合成,路线如图所示:

(1)A生成B的反应条件是___,B生成C的反应条件为___。
(2)合成过程中,属于取代反应的是___。
(3)F的结构简式为___。
(4)D在一定条件下能生成高分子化合物,请写出该反应的化学方程式___。同时符合下列三个条件的D的同分异构体共有___种。
a.能发生银镜反应;
b.苯环上有3个取代基;
c.与FeCl3溶液发生显色反应。
(5)依据以上合成信息,以乙烯和氯苯为原料合成 路线,无机试剂自选___。
路线,无机试剂自选___。
【答案】氢氧化钠水溶液,加热(或![]() ) 铜或银做催化剂,加热(或
) 铜或银做催化剂,加热(或![]() ) ①④⑤⑦
) ①④⑤⑦  n
n 10
10 
【解析】
(1)A生成B是卤代烃的水解;B生成C是醇氧化为醛;
(2)取代反应是有机物分子中的原子或原子团被其它的原子或原子团代替的反应;
(3)由 逆推F的结构简式;
逆推F的结构简式;
(4)D分子中含有碳碳双键,在一定条件下发生加聚反应生成高分子化合物;D的同分异构体,a.能发生银镜反应,说明含有醛基; b.苯环上有3个取代基; c.与FeCl3溶液发生显色反应,说明含有酚羟基;
(5)乙烯和水发生加成反应生成乙醇,乙醇氧化为乙醛、乙醛氧化为乙酸,乙酸在SOCl2作用下生成乙酰氯,氯苯水解为苯酚,苯酚和乙酰氯反应生成 ;
;
(1)A生成B是卤代烃的水解,反应条件是氢氧化钠水溶液,加热;B生成C是醇氧化为醛,反应条件为铜或银做催化剂,加热;
(2) 是氯原子被羟基代替;
是氯原子被羟基代替; 是羟基被氯原子代替;
是羟基被氯原子代替; 是氯原子被
是氯原子被![]() 代替;
代替; 是甲基被氢原子代替,所以属于取代反应的是①④⑤⑦;
是甲基被氢原子代替,所以属于取代反应的是①④⑤⑦;
(3)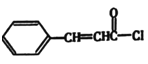 和F反应生成
和F反应生成 ,由G逆推可知F的结构简式是
,由G逆推可知F的结构简式是 ;
;
(4)D分子中含有碳碳双键,在一定条件下发生加聚反应生成高分子化合物,反应方程式是n ; a.能发生银镜反应,说明含有醛基; b.苯环上有3个取代基; c.与FeCl3溶液发生显色反应,说明含有酚羟基,则3个取代基是-OH、-CHO、-CH=CH2,3个不同的取代基在苯环上的位置异构有10种,所以符合条件的D的同分异构体有10种;
; a.能发生银镜反应,说明含有醛基; b.苯环上有3个取代基; c.与FeCl3溶液发生显色反应,说明含有酚羟基,则3个取代基是-OH、-CHO、-CH=CH2,3个不同的取代基在苯环上的位置异构有10种,所以符合条件的D的同分异构体有10种;
(5)乙烯和水发生加成反应生成乙醇,乙醇氧化为乙醛、乙醛氧化为乙酸,乙酸在SOCl2作用下生成乙酰氯,氯苯水解为苯酚,苯酚和乙酰氯反应生成 ,合成路线为
,合成路线为 ;
;


科目:高中化学 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知:反应aA(g)+bB(g)cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
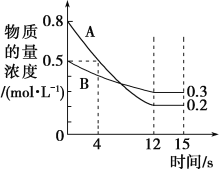
(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为___。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______________。
II.298 K时,将20 mL 3x mol·L-1 Na3AsO3、20 mL 3x mol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO![]() (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq)![]() AsO
AsO![]() (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。

(1)下列可判断反应达到平衡的是________(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO![]() )
)
c.![]() 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1
(2)tm时,v正____v逆(填“大于”“小于”或“等于”)。
(3)tm时v逆____tn时v逆(填“大于”“小于”或“等于”),理由是________。
III.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。溶液中OH-向电极__(填“a”或“b”)移动,负极的电极反应式为:___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.![]() C和
C和![]() C是同一种核素
C是同一种核素
B.红磷和白磷互为同素异形体
C.CH3COOCH2CH3和CH3CH2COOCH3是不同物质
D.CH3CH2OH可看成是由-C2H5和-OH组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素。根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图_______________________。
(2)写出化合物E2F2的电子式________,化合物ABC的结构式________。
(3)根据题目要求完成以下填空:BF32-中心原子杂化方式________;D3中心原子杂化方式________;FD42-微粒中的键角________;FD3分子的立体构型________。
(4)根据等电子原理,指出与BD2互为等电子体且含有C原子的微粒有________、________(要求写一种分子和一种离子)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组需要480 mL 0.1000 mol/L的NaOH溶液。欲在实验室用固体烧碱配制。请回答下列问题:
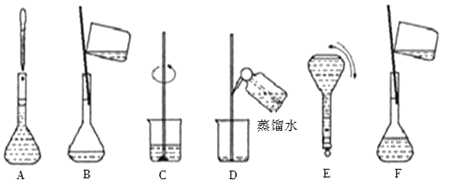
(1)本实验需用托盘天平称量烧碱的质量为_____g。
(2)配制过程中,不需要的仪器(填写代号)________________。
a.烧杯 b.冷凝管 c.玻璃棒 d.1000mL容量瓶 e.漏斗 f.胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器有药匙、___、___。
(4)请说出本实验中玻璃棒的作用____________。
(5)将上图中的实验步骤A~F按实验过程先后次序排列______________。
(6)若配制过程中,其他操作都准确,下列操作能引起浓度偏高的有______(填代号)。
①用来溶解NaOH的烧杯里面有少许水
②未等稀释后的NaOH溶液冷却至室温就转移到容量瓶中
③将NaOH溶液转移到容量瓶时,不小心撒到了外面少许
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,空气环境受到了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A.反应中NO为氧化剂,N2为氧化产物
B.汽车尾气的主要污染成分包括CO、NO和N2
C.NO和O2必须在催化剂表面才能反应
D.催化转化总化学方程式为2NO+O2+4CO 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不粘锅的内壁有聚四氟乙烯涂层,下列关于聚四氟乙烯的说法正确的是( )
A. 聚四氟乙烯的单体是不饱和烃
B. 聚四氟乙烯比较稳定
C. 聚四氟乙烯中氟的质量分数是73.1%
D. 聚四氟乙烯分子中含有双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com