
| A、由非金属元素组成的化合物不一定是共价化合物 |
| B、X2+的核外电子数目为18,则X在第三周期ⅡA族 |
| C、HF很稳定是因为其分子间能形成氢键 |
| D、同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、Li Na K Rb |
| B、NaF NaCl NaBr NaI |
| C、F2 Cl2 Br2 I2 |
| D、H2O H2S H2Se H2Te |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 12 |
| A、④⑤ | B、只有② |
| C、只有⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 纯净物根据其组成和性质可进行如下分类.
纯净物根据其组成和性质可进行如下分类.| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 相对分子质量 | ||
| 盐酸 | HCl | 36.5 | 密度:1.20g?mL-1 质量分数:36.5%,无色易挥发 |
| 氢氧化钠 | NaOH | 40 | 俗名:烧碱、火碱、苛性钠,易潮解的固体 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| 乙醚 |


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NF3分子中所有原子共平面 |
| B、NF3在反应中既做氧化剂又做还原剂 |
| C、生成0.2mol HNO3时转移0.2mol电子 |
| D、氧化产物与还原产物的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 的路线如下:
的路线如下:
| 一定条件 |
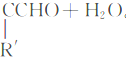
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com