
A、CH4分子的球棍模型: | ||
B、Cl-离子的结构示意图: | ||
C、氟化钠的电子式: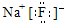 | ||
D、中子数为146、质子数为92 的铀原子
|
 ,故B错误;
,故B错误;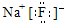 ,故C正确;
,故C正确;238 92 |


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 |
| B、SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆 |
| C、鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 |
| D、焰火“脚印”、“笑脸”,使北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”的知识相关,焰色反应是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将40 gNaOH溶于1L水中,所得NaOH溶液的浓度为1 mol?L-1 | ||
| B、将2.3gNa投入到97.7g水中充分反应,所得溶液中溶质的质量分数为4.0% | ||
C、在t℃时,将a g NH3完全溶液水,得到VmL溶液.该溶液的物质的量浓度为
| ||
| D、1 mol?L-1的硫酸溶液中c(H+)=1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A、整个过程中阳极先产生Cl2,后产生O2 |
| B、阳极极产物一定是Cl2,阴极产物一定是Cu |
| C、BC段表示在阴极上是H+放电产生了H2 |
| D、CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2?2H2O晶体,拟定实验步骤如图所示:请回答下列问题:
CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2?2H2O晶体,拟定实验步骤如图所示:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(N2O4)/mol | 0 | 0.12 | 0.18 | 0.20 | 0.20 |
| A、反应在前50 s的平均速率为v(NO2)=0.001 2 mol?L-1?s-1 |
| B、保持温度不变,向平衡后的容器中充入1.0 mol N2O4时,v(正)>v(逆) |
| C、保持其他条件不变,升高温度达到新平衡时K=0.125,则正反应的△H<0 |
| D、T温度时,若起始向容器中充入2.0 mol N2O4,则平衡时N2O4的转化率大于80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com