
| A. | 0.5mol锌粒与足量盐酸反应产生11.2L H2 | |
| B. | 标准状况下,11.2L H2O所含分子数为0.5NA | |
| C. | 0.5mol•L-1的MgCl2溶液中含有Cl-个数为NA | |
| D. | 25℃、101Pa时,16g O2和O3混合气体中含有的原子数为NA |
分析 A、0.5mol锌能与盐酸反应生成0.5mol氢气;
B、标况下水为液态;
C、溶液体积不明确;
D、氧气和臭氧均由氧原子构成.
解答 解:A、0.5mol锌能与盐酸反应生成0.5mol氢气,但氢气的状态不明确,故体积不一定是11.2L,故A错误;
B、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D、氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量为n=$\frac{16g}{16g/mol}$=1mol,个数为NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
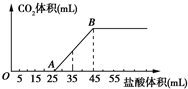
| A. | OA段发生反应的离子方程式为:H++OH-═H2O CO${\;}_{3}^{2-}$+H+═HCO${\;}_{3}^{-}$ | |
| B. | 当加入35 mL盐酸时,产生CO2的体积为224 mL | |
| C. | A点溶液中的溶质为NaCl、NaHCO3 | |
| D. | 混合物中NaOH的质量0.60 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质谱和核磁共振不仅可用于有机小分子结构的分析,还可用于蛋白质结构的研究 | |
| B. | 储氢金属吸氢形成金属氢化物,改变条件释放吸收的氢气,是氢气贮存的重要途径 | |
| C. | 牺牲阳极的阴极保护法、外加电源的阳极保护法和改变金属组成或结构的方法都是 防止金属腐蚀的方法 | |
| D. | 乙醇与水互溶,这与乙醇和水分子之间能形成氢键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| B. | 氢氧化钡溶液与稀硫酸混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 碳酸钙溶于稀醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入HCl | B. | 加少量NH4Cl固体 | C. | 加少量NaCl固体 | D. | 通入氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 标准状况下,2024L乙醇含有0.1nA个CH3CH2OH分子 | |
| D. | KIO3+6HI=KI+3H2O+3I2,生产3molI2转移电子的总数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com