
下表所列各组物质中,物质之间通过一步反应不能实现“甲 乙
乙 丙”转化的是
丙”转化的是
物质 选项 | 甲 | 乙 | 丙 |
A | Si | SiO2 | H2SiO3 |
B | NO | NO2 | HNO3 |
C | Na | NaCl | NaOH |
D | CH2=CH2 | CH3CH2OH | CH3CHO |
科目:高中化学 来源:2015届广东省湛江市高一第一学期期中考试化学试卷(解析版) 题型:选择题
“纳米技术是当今科学研究的前沿之一,l纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中,“纳米材料是指研究、开发出的直径从几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是
A.所得分散系不稳定 B.一定能形成溶液
C.不能透过滤纸 D.有丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连
B.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C.一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0
D.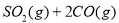

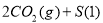 达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高
达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
一定条件下存在反应:2SO2(g) + O2(g) 2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A.容器I、Ⅲ中平衡常数相同
B.容器II、Ⅲ中正反应速率相同
C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:II>III
D.容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:
下列结论正确的是
A.X中肯定存在Na+、Fe2+、A13+、NH4+、SO42-
B.气体F经催化氧化可直接生成气体D
C.沉淀C一定是BaSO4、 沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D.X中不能确定的离子是 A13+、Na+、K+和C1-
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:填空题
(14分)合成氨是人类科学技术上的一项重大突破。
(1)NH3经一系列反应可以得到HNO3和NH4NO3。
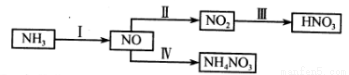
II中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。

①随温度升高,该反应平衡向__________(选填“正反应”或“逆反应”)方向移动。
②比较P1、P2的大小关系:______________。
(2)一种工业合成氨的简易流程图如下:
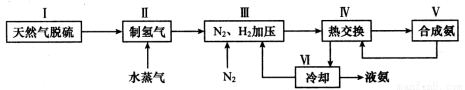
步骤II中制氢气原理如下:
a.CH4(g)+H2O(g) CO(g)+3H2(g) △H = +206.4 kJ/mol
CO(g)+3H2(g) △H = +206.4 kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g) △H = —41.2 kJ/mol
CO2(g)+H2(g) △H = —41.2 kJ/mol
①对于反应a而言,增大CH4的浓度,达新平衡时H2的体积分数_ _ __增大(选填“一定”或“不一定”)。
②利用反应b,将CO进一步转化,可提高H2产量。若在500 ℃时,把等浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005 mol·L-1、c(H2)=0.015 mol·L-1,则CO的平衡转化率为 。
③上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,④简述一种本流程中可以提高合成氨原料总转化率的方法 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:选择题
反应A(g)+2B(g)===C(g)的反应过程中能量变化如下图所示。下列相关说法正确的是
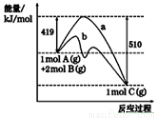
A.正反应活化能大于逆反应活化能
B.曲线b表示使用催化剂后的能量变化
C.由图可知该反应的焓变ΔH=+ 91 kJ·mol-1
D.反应中将气体A换为固体反应,其他条件不变,反应放出热量小于91kJ
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:实验题
(16分)粗食盐中除含有泥沙等不溶性杂质外,还含有钙离子、镁离子、硫酸根离子等可溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通常经过以下步骤:①加入稍过量的BaCl2 溶液;②加入稍过量的NaOH溶液;③加入稍过量的Na2CO3溶液;④过滤;⑤滴入稀盐酸至无气泡产生;⑥蒸发结晶。
回答下列问题。
(1)步骤①中的BaCl2 溶液还可以换成__________(填字母)。
A.Ba(NO3)2溶液 B.Ba(OH)2溶液 C.A和B均可以
(2)步骤③中所发生反应的离子方程式为__________________________、________________________。
(3)步骤⑥需使用玻璃棒,其目的是________________________________________________________。
(4)步骤①、步骤②、步骤③的顺序还可以是______________________或________________________。
(5)用上述过程中获得的精盐配制240mL 0.8mol·L-1 NaCl溶液,步骤如下:计算→称量→溶解→转移→洗涤→定容→摇匀。
a.需要的NaCl固体质量为_________g;
b.定容时,当液面离刻度线1~2cm时应改用_________(填仪器名称)加水。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(14分)铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是____ 。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
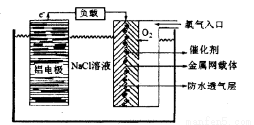
①该电池的总反应化学方程式为____ ;
②电池中NaCI的作用是 。
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为 。
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCI溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为 。(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为 。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com