
分析 (1)依据配制溶液体积选择合适规格容量瓶,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
(2)根据实验操作的步骤(计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等操作)选择需要仪器;
(3)定容时俯视刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$进行误差分析;
(4)根据方程式计算参加反应的锌、硫酸的物质的量;根据m=nM计算锌的质量,溶液中n(H+)=n(H2SO4),计算出硫酸的物质的量浓度变化量,即氢离子浓度变化量,氢离子开始浓度减去氢离子浓度变化量等于反应后溶液中的氢离子的物质的量浓度.
解答 解:(1)配制240mL 0.9mol/L的稀硫酸,应选择250mL容量瓶,实际配制250mL溶液,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18mol/L×V=250mL×0.9mol/L,解得V=12.5mL;
故答案为:12.5;
(2)用浓溶液配制一定物质的量浓度稀溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,用到的仪器依次为:量筒、胶头滴管、烧杯、玻璃棒、容量瓶,配制240mL 0.9mol/L的稀硫酸,应选择250mL容量瓶,所以还缺少的仪器:250 mL容量瓶、胶头滴管、玻璃棒;
故答案为:250 mL容量瓶、胶头滴管、玻璃棒;
(3)定容时俯视刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$,n不变,V偏小,则溶液浓度偏高,所以所得溶液浓度 大于0.9mol•L-1;
故答案为:大于;
(4)Zn+H2SO4=ZnSO4+H2↑
1mol 1mol 22.4L
x y 0.448L
所以x=$\frac{0.448L}{22.4L/mol}$=0.02mol.
y=x=0.02mol.
所以参加反应锌的质量为0.02mol×65g/mol=1.3g.
氢离子浓度变化量为△c(H+)=$\frac{0.02mol×2}{0.1L}$=0.4mol/L.
所以反应后溶液中的氢离子的物质的量浓度为2×0.9mol/L-0.4mol/L=1.4mol/L,
故答案为:1.3;1.4.
点评 本题考查了物质的量浓度的计算、一定物质的量浓度溶液的配制,明确配制原理及物质的量浓度概念及计算公式为解答关键,试题培养了学生的分析、理解能力及化学计算能力,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
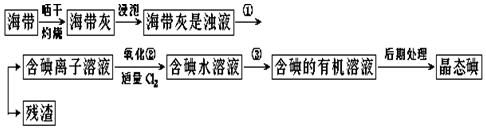
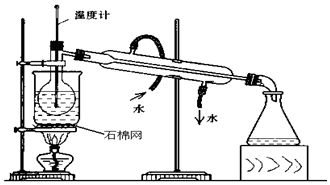
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C 与 14C | B. | CH3CH2OH与CH3COOH | ||
| C. | 甲烷与丙烷 | D. | CH3CH2CH2CH3 与 CH3CH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
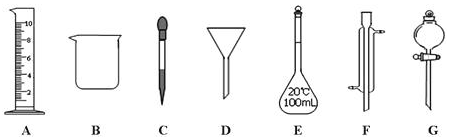
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
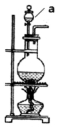 欲设计一个实验验证红热的炭与浓硫酸发生反应所生成的各种产物.某同学设计的实验流程依次为:气体产物、无水硫酸铜、品红溶液1、酸性高锰酸钾、品红溶液2、澄清石灰水.
欲设计一个实验验证红热的炭与浓硫酸发生反应所生成的各种产物.某同学设计的实验流程依次为:气体产物、无水硫酸铜、品红溶液1、酸性高锰酸钾、品红溶液2、澄清石灰水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
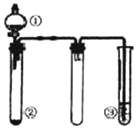 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
| B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
| C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
| D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com