

| A. | 天然气燃烧 | B. | 浓硫酸倒入水中 | ||
| C. | 用氢气还原氧化铜 | D. | 铝热反应 |
科目:高中化学 来源: 题型:选择题
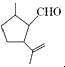 ,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )
,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )| A. | 先加酸性高锰酸钾溶液,后加银氨溶液,加热 | |
| B. | 先加溴水,后加酸性高锰酸钾溶液 | |
| C. | 先加银氨溶液,加热,再加入溴水 | |
| D. | 先加入新制氢氧化铜悬浊液,加热,取清液酸化后再加溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③④ | C. | ①②③⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | m+n>p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率减小 | D. | C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | ′ | R |
| W |
| A. | 原子半径大小关系为:R>Y>X | |
| B. | X有多种同素异形体,而Y不存在同素异形体 | |
| C. | 根据元素周期律t可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性 | |
| D. | 氢化物熔沸点:H2R>H2Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com