
| A、Ag+ NO3- Cl- H+ |
| B、Ba2+ SO42- NO3- Na+ |
| C、Ba2+ Mg2+ NO3- Cl- |
| D、CO32- H+ OH- Ca2+ |
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
| A、HCO3-的水解方程式可表示为:HCO3-+H2O?H3O++CO32- |
| B、向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)3Fe+8 H++2NO3-=3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何气体的体积都是22.4L |
| B、1molH2的质量是2g?mol-1,它所占的体积是22.4L?mol-1 |
| C、标准状况下,1moL任何物质所占的体积都约为22.4L |
| D、标准状况下,1mol任何气体所占的体积都约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①②⑤⑥ |
| C、③⑤⑥⑦ | D、①③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、刚充人时反应速率:v(正)减小,v(逆)增大 |
| B、达到新的平衡时:反应混合物中A、B的物质的量分数不变 |
| C、达到新的平衡时:c(A):c(B):c(C)仍为1:1:2 |
| D、达到新的平衡过程中:体系压强先增大,后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
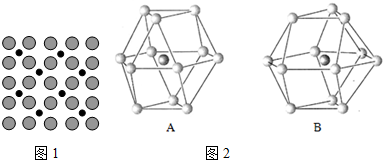
| N |
| Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com