
科目:高中化学 来源: 题型:
已知:2CH3OH(g)  CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol 某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol 某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.8 | 1.24 | 1.24 |
下列说法正确的是( )
A. 平衡时,c(CH3OCH3)=1.6 mol/L B.平衡后升高温度,平衡常数>400
C. 平衡时,反应混合物的总能量减少20 kJ
D. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
阅读下面两则科普信息,回答有关问题:
一个体重50 kg的健康人身体中含铁2 g,这2 g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶作催化剂,把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿。该反应的另一种反应物是CO2,反应后CO2转变成有机物(可用甲醛CH2O来表示)。
(1)这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明维生素C具有 还原 性,铁离子具有 氧化 性,第二则信息中CO2是 氧化 剂。
(2)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+。制取铁酸钠的化学方程式如下:
2 Fe(NO3)3+ 16 NaOH+ 3 Cl2=== 2 Na2FeO4+ 6 NaNO3+ 6 NaCl+ 8 H2O
①配平上述反应,并分析 铁 元素被氧化,当生成3mol还原产物时,转移电子的总数为 3NA ;
②铁酸钠除了能消毒外,还可以用于净水,原因是 还原产物Fe3+水解生成Fe(OH)3胶体,吸附水中的杂质而净水 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知卤代烃和NaOH的醇溶液共热可以得到烯烃,如:
CH3CH2Cl+NaOH CH2==CH2+NaCl+H2O
CH2==CH2+NaCl+H2O
现通过以下步骤由 制取
制取 ,其合成流程如下:
,其合成流程如下:

请回答下列问题:
(1)从左向右依次填写每步所属的反应类型是(a.取代反应 b.加成反应 c.消去反应)__________(只填写字母)。
(2)写出A B所需的试剂和反应条件。
B所需的试剂和反应条件。
(3)写出 这两步反应的化学方程式。
这两步反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y是同一周期的两种主族元素,它们可能组成XY2型共价化合物,X、Y元素在周期表中的原子序数可能是( )。
A、6、8 B、11、17 C、11、16 D、12、17
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中既属于氧化还原反应又属于放热反应的是 ( )
A 氢氧化钾与硫酸的反应 B 锌与盐酸反应放出氢气
C 镁条在空气中燃烧 D Ba(OH)2•8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,请回答有关问题:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | ||||||
| 2 | ① | ② | ③ | |||||||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||
| 4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ,④元素原子结构示意图为 ,⑦元素的离子结构示意图为 ,⑨元素的离子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式 。
(3)④元素与⑦元素形成化合物的电子式 ,①元素与⑦元素形成化合物的电子式 ,④元素与⑥元素形成化合物的电子式 ,
⑦元素单质的电子式 ,②元素单质的电子式 。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式),④,⑤,⑨三种元素的最高价氧化物的水化物中碱性最弱的是 (填化学式)。④,⑤,⑥、⑦四种元素中非金属性最强的是 (用元素符号表示)。
(5)⑨元素与③元素形成化合物的形成过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应3Cl2+6NaOH 5NaCl+NaClO3+3H2O,以下叙述正确的
5NaCl+NaClO3+3H2O,以下叙述正确的 是
是
A.Cl2是氧化剂,NaOH是还原剂
B.当有6.72L Cl2反应时,转移电子物质的量为0.5mol
C.氧化剂得电子总数与还原剂失电子总数之比为1∶1
D.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2SO2(g)+O2(g) 2SO3(g) 。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)、温度(T)的关系分别如图甲、丙所示。
2SO3(g) 。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)、温度(T)的关系分别如图甲、丙所示。
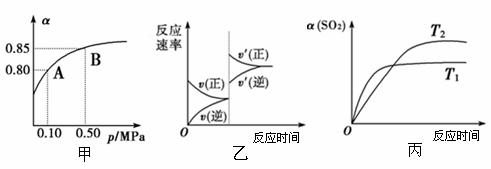
则下列说法正确的是
A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.由图丙知,T1>T2,且该反应的正反应为放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com