运用化学反应原理分析解答以下问题.
(1)以CH
4和H
2O为原料制备二甲醚和甲醇的工业流程如下:
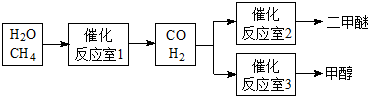
已知:CH
4 (g)+CO
2(g)═2CO(g)+2H
2 (g)△H
1═+247.4kJ?mol
-1CH4 (g)+2H
2O(g)═CO
2(g)+4H
2(g)△H
2+165.0kJ?mol
-1①CH
4(g)与H
2O (g)反应生成CO(g)和H
2(g)的热化学方程式为
.
②反应室3(容积为VL)中a mol CO与2a mol H
2在催化剂作用下反应生成甲醇:
CO(g)+2H
2(g)?CH
3OH(g),CO的平衡转化率与温度、压强的关系如图1所示,则:P
1
P
2(填“<”、“>”或“=”).在P
1压强下,100℃时,反应:CH
3OH(g)?CO(g)+2H
2(g)的平衡常数为
.(用含a、V的代数式表示).
③保持温度和容积一定,反应室3再增加a mol CO与2a mol H
2,达到新平衡时,CO的转化率
.(填“增大”、“减小”或“不变”)
(2)甲醇是新能源电池的燃料,但它对水质会造成一定的污染.有一种电化学法可消除这种污染.其原理是:2滴甲醇,1mL 1.0mol?L
-1硫酸,4mL 0.1mol?L
-1硫酸钴(CoSO
4)混合溶液,插上两根惰性电极,通电后,将Co
2+氧化成Co
3+,然后以Co
3+做氧化剂把水中的甲醇氧化成CO
2而净化.实验室用如图2装置模拟上述过程:
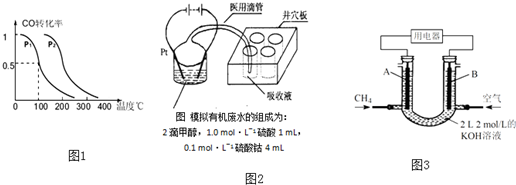
①检验电解时产生的CO
2气体,井穴板穴孔内应盛放
溶液.
②写出净化甲醇的离子方程式
.
(3)将CH
4设计成燃料电池,其利用率更高,装置如图3所示(A、B为多孔性石墨棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①0<V≤44.8L时,电池负极电极反应为:
;
②V=67.2L时,溶液中离子浓度大小关系为
.





 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案