
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
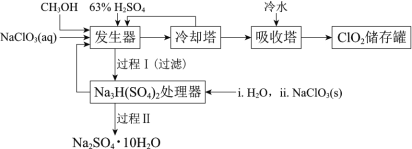
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH=12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2Ob.相关物质的熔沸点:

(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有_____性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为 ______________(填字母)。
a.0~10℃ b.20~30℃ c.60~70℃
(3)可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如图:

① Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因 __(结合方程回答)。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,_______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和_____。
(4)为测定存储罐中所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇 匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
①准确量取10.00 mL ClO2溶液的玻璃仪器是______。
②若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果_____ (填“偏高”、“偏低”或“无影响”)
③根据上述步骤可计算出原ClO2溶液的浓度为_____mol·L-1(用含字母的代数式表示)。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为_______。(计算结果保留两位小数)
【答案】氧化 B Na2SO410H2O(s)2Na+(aq)+SO42-(aq)+10H2O(l),加入NaClO3使溶液中c(Na+)增大,平衡逆向移动,使Na2SO410H2O晶体析出 冷却结晶、过滤、洗涤、干燥 H2SO4 酸式滴定管 偏高 ![]() 2.63g
2.63g
【解析】
发生器中发生反应:12NaClO3+8H2SO4+3CH3OH═12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O,过滤得到不溶性Na3H(SO4)2滤渣和含有CH3OH等物质的滤液,滤液在冷却塔中冷却分离出ClO2气体,含有CH3OH等物质的滤液循环到发发生器中,充分利用原料CH3OH和NaClO3,ClO2气体在吸收塔中冰水冷却至液体ClO2储存;处理器中,Na3H(SO4)2滤渣在Na+作用下与水转化为Na2SO410H2O和H2SO4,过滤得到芒硝Na2SO410H2O,滤液中的H2SO4和NaClO3循环到发生器中充分利用,据此分析解答(1)~(3);
(4)ClO2溶液显酸性,结合2ClO2+10I-+8H+=2Cl-+5I2+4H2O、I2+2S2O32-═2I-+S4O62-得关系式ClO2~5S2O32-,据此计算原ClO2溶液的浓度;
(5)根据每克含氯消毒剂转移的电子,结合ClO2~Cl-~5e-,Cl2~2Cl-~2e-分析计算。
(1)ClO2具有强氧化性,可用于纸浆漂白、杀菌消毒,故答案为:氧化;
(2)ClO2的沸点为11℃,CH3OH沸点为65℃,便于分离气态的ClO2和液态的含有CH3OH的滤液,冷却塔中控制的温度在11~65℃之间,结合后续实验的冷却,则最佳温度应该控制在20~30℃,故答案为:B;
(3)①Na2SO410H2O晶体在溶液中存在溶解和结晶的平衡,即Na2SO410H2O(s)2Na+(aq)+SO42-(aq)+10H2O(l),根据平衡移动原理可知,加入NaClO3使溶液中c(Na+)增大,平衡逆向移动,使Na2SO410H2O晶体析出,故答案为:Na2SO410H2O(s)2Na+(aq)+SO42-(aq)+10H2O(l),加入NaClO3使溶液中c(Na+)增大,平衡逆向移动,使Na2SO410H2O晶体析出;
②由Na2SO410H2O和Na2SO4的溶解度曲线可知,32.4℃时Na2SO410H2O和Na2SO4的溶解度均处于最大,但Na2SO410H2O的溶解度随温度的升高而增大,Na2SO4的溶解度随温度的升高而较小,防止Na2SO4结晶析出,应采用降温结晶法得到Na2SO410H2O,即恒温蒸发浓缩溶液、冷却结晶、过滤、洗涤、干燥,故答案为:冷却结晶、过滤、洗涤、干燥;
③在Na+作用下,Na3H(SO4)2滤渣在处理器中与水转化为Na2SO410H2O和H2SO4,过滤得到芒硝Na2SO410H2O,滤液中的H2SO4和NaClO3循环到发发生器中充分利用,故答案为:H2SO4。
(4)①ClO2溶液显酸性,所以准确量取10.00 mL ClO2溶液的玻璃仪器是酸式滴定管,故答案为:酸式滴定管;
②Na2S2O3标准溶液部分因被氧气氧化而变质,则消耗的Na2S2O3标准溶液体积偏大,根据I2+2S2O32-=2I-+S4O62-,2ClO2+10I-+8H+=2Cl-+5I2+4H2O可知,测得的ClO2偏多,导致测定结果偏高,故答案为:偏高;
③由方程式2ClO2+10I-+8H+=2Cl-+5I2+4H2O、I2+2S2O32-═2I-+S4O62-得关系式ClO2~5S2O32-,n(S2O32-)=cV2×10-3mol,所以V1mL ClO2的溶液中含有的ClO2的物质的量为2cV2×10-4mol,则10mL的原溶液含有ClO2的物质的量为:2cV2×10-4mol×![]() =
=![]() ×10-2mol,所以原ClO2溶液的物质的量浓度为
×10-2mol,所以原ClO2溶液的物质的量浓度为 =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() ;
;
(5)根据有效氯定义,1gC1O2的物质的量为![]() mol,依据电子转移数目相等,ClO2~Cl-~5e-,Cl2~2Cl-~2e-,则转移电子为
mol,依据电子转移数目相等,ClO2~Cl-~5e-,Cl2~2Cl-~2e-,则转移电子为![]() mol,可知氯气的物质的量为
mol,可知氯气的物质的量为![]() ×
×![]() mol,则氯气的质量为
mol,则氯气的质量为![]() ×
×![]() mol×71g/mol=2.63g,故答案为:2.63g。
mol×71g/mol=2.63g,故答案为:2.63g。


科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中物质分离的操作为过滤
B. 该工艺中I2和HI的相互转化体现了“碘循环”
C. 反应器和膜反应器中分别发生了非氧化还原反应和氧化还原反应
D. 碘循环工艺的总反应为2SO2 + 4H2O + I2 == H2+ 2H2SO4+ 2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置制取溴苯,回答下列问题:

(1)写出A中反应的化学方程式:_________________
(2)C中盛放CCl4的作用是_________
(3)D中加入硝酸银溶液,实验后溶液中能看到的的实验现象为________
(4)常用于鉴别苯和甲苯的试剂为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期主族元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示的变化,其中A为X、Y组成的双原子分子,B和C均为10电子分子。下列说法不正确的是( )

A.X元素位于第VIA族B.A不能溶于B中
C.A是典型的酸性氧化物D.B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-。下列有关说法正确的是( )

A.电池工作时,正极a附近的pH将不断增大
B.电池工作时,c溶液中的溶质是MgCl2
C.负极反应式:ClO-+2e-+H2O=Cl-+2OH-
D.a电极发生还原反应,每转移0.2mol电子,理论上生成0.2molCl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学元素形成的单质或化合物在工农业生产、军事国防、医疗生活各个领域发挥着重要的作用。
(1)钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82—+8H2O![]() 2MnO4—+10SO42—+16H+
2MnO4—+10SO42—+16H+
①基态S原子核外有____种不同空间运动状态的电子。
②已知H2S2O8的结构如图所示:

H2S2O8中硫原子的轨道杂化方式为________;上述反应每生成1molMnO4—,S2O82—断裂的共价键类型及其数目分别为________、__________(设阿伏伽德罗常数的值为NA)
(2)Fe可以与CN—、H2NCONH2(尿素)等多种配体形成配合物。
①请写出与CN—互为等电子体的一种分子:______、一种离子:_________。
②组成尿素的第二周期元素的第一电离能由大到小的顺序为:________,1molH2NCONH2(尿素)分子中含有σ键的数目为_______。
③FeN的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x—n)CunNy。

Cu处于周期表中_____区,其最高能层的符号为____,基态铜原子的价电子排布式为________。FexNy转化为两种Cu的替代型产物的能量变化如图2所示,其中相对不稳定的Cu替代型产物的化学式为_________。
(3)铬是银灰色的结晶体,质硬而脆,是制造不锈钢、高速钢的重要原料。
①CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是____(填“极性”或“非极性”)分子
②CrCl3·6H2O实际上是配合物,配位数是6,其固体有三种颜色,其中一种浅绿色固体于足量硝酸银反应时,1mol固体可生成1molAgCl沉淀,则这种浅绿色固体中阳离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g)。2 min时测得生成0.8 mol D、0.4 mol C。下列判断不正确的是
A. x=1
B. 2 min时,A的浓度为0.9mol·L-1
C. 2 min内A的反应速率为0.3 mol·L-1·min-1
D. B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是一种常用的净水剂,甲、乙两小组分别用如图装置制备无水FeCl3并证明产品中没有FeCl2,已知无水FeCl3在空气中易潮解,加热易升华。
I.小组甲拟用如图实验装置来制备无水FeCl3。(每个虚线框表示一个单元装置)

(1)请用文字描述方法改正以上装管的两处错误__________________________。
II.小组乙用下列装置组装制备无水FeCl3。

(2)A中发生反应的离子方程式为______________________________。
(3)装置接口的连接顺序为________(用a、b、c……i表示):反应开始前应先点燃____处酒精灯(填“A”或“C”)。
(4)装置B的作用______________________________。
(5)证明产品中没有FeCl2的试剂是____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将含等物质的量的硫酸亚铁和硫酸铁的溶液混合,再滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在![]() 的磁流体。下列说法中正确的是( )
的磁流体。下列说法中正确的是( )
A.该磁流体是一种纯净物B.所得的磁流体为悬浊液
C.该磁流体很不稳定D.所得的磁流体能产生丁达尔效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com