
| A、在反应KIO3+6 HI=KI+3I2+3 H2O中,每生成3mo1 I2转移的电子数为5NA |
| B、室温下,28.0g乙烯和丁烯的混合气体中含有的碳原子数目为3NA |
| C、在1L0.1mol?L-1碳酸钠溶液中,阴离子总数小于0.1NA |
| D、1mol Na2O2 固体中含离子总数为4 NA |
| 28.0g |
| 14g/mol |
| 28.0g |
| 14g/mol |


科目:高中化学 来源: 题型:
| A、2.4×10-7mol/L |
| B、0.1×10-7mol/L |
| C、(1×10-14)/(2.4×10-7)mol/L |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
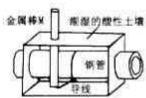 全世界短年钢铁因锈蚀造成大量的损失.某城市拟用如图所示方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀.关于此方法,下列说法不正确的是( )
全世界短年钢铁因锈蚀造成大量的损失.某城市拟用如图所示方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀.关于此方法,下列说法不正确的是( )| A、土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池 |
| B、金属棒X的材料应该是比镁活泼的金属 |
| C、金属棒X上发生反应:M-ne---Mn+ |
| D、这种方法称为牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电子总数 | B、质子总数 |
| C、分子总数 | D、氮原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该混盐与硫酸反应产生1molC12时转移2NA个电子 |
| B、该混盐的水溶液呈碱性 |
| C、该混盐具有较强的氧化性 |
| D、该混盐中氯元素的化合价为+1和-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、A、B、C三者中,A为金属性元素,B、C为非金属性元素 |
| B、A、B、C三者核电荷数之和为40 |
| C、A与B、A与C均可形成离子化合物 |
| D、B与C只能形成一种共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
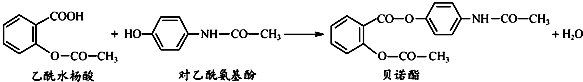
| A、1mol贝诺酯分子可与9mol H2完全反应 |
| B、可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C、贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
| D、乙酰水杨酸和乙酰氨基酚均可与NaHCO3溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com